名校
解题方法
1 . 按要求回答下列问题:
(1)下列变化中属于吸热反应的是___________ (填序号)。
①铝片与稀盐酸的反应;②将胆矾加热变为白色粉末;③干冰汽化;④甲烷在氧气中的燃烧反应;⑤ 固体溶于水;⑥C与
固体溶于水;⑥C与 反应生成CO
反应生成CO
(2)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为: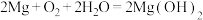 。下列说法正确的是
。下列说法正确的是___________ (填字母序号)。
b. 发生氧化反应
发生氧化反应
c.海水溶液中阴离子移向Mg极
d.电池工作时,电子转移方向:石墨→海水→Mg
(3)下图是一氧化碳和氧在钌催化剂表面形成化学键的过程。下列说法正确的是___________。
(4)合成氨工业中,合成塔中每产生2 mol ,放出92.2 kJ热量,已知断开1 mol
,放出92.2 kJ热量,已知断开1 mol 键、1 mol
键、1 mol 键分别需要吸收的能量为436 kJ、945.8 kJ;则1 mol
键分别需要吸收的能量为436 kJ、945.8 kJ;则1 mol  键断裂吸收的能量约等于
键断裂吸收的能量约等于___________ kJ。
(5)若将两个金属棒用导线相连在一起,总质量为80.00g的镁片和铝片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为74g,则装置工作时负极电极反应式为___________ ,工作时间内装置所产生氢气的体积为___________ L(标准状况)。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应;②将胆矾加热变为白色粉末;③干冰汽化;④甲烷在氧气中的燃烧反应;⑤
 固体溶于水;⑥C与
固体溶于水;⑥C与 反应生成CO
反应生成CO(2)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为:
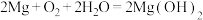 。下列说法正确的是
。下列说法正确的是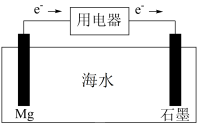
b.
 发生氧化反应
发生氧化反应c.海水溶液中阴离子移向Mg极
d.电池工作时,电子转移方向:石墨→海水→Mg
(3)下图是一氧化碳和氧在钌催化剂表面形成化学键的过程。下列说法正确的是___________。
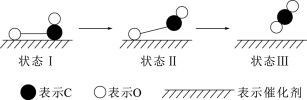
A. 和CO均为酸性氧化物 和CO均为酸性氧化物 | B.该过程中,CO先断键成C和O |
C.状态 到状态 到状态 为放热过程 为放热过程 | D.图示表示CO和 反应生成 反应生成 的过程 的过程 |
(4)合成氨工业中,合成塔中每产生2 mol
 ,放出92.2 kJ热量,已知断开1 mol
,放出92.2 kJ热量,已知断开1 mol 键、1 mol
键、1 mol 键分别需要吸收的能量为436 kJ、945.8 kJ;则1 mol
键分别需要吸收的能量为436 kJ、945.8 kJ;则1 mol  键断裂吸收的能量约等于
键断裂吸收的能量约等于(5)若将两个金属棒用导线相连在一起,总质量为80.00g的镁片和铝片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为74g,则装置工作时负极电极反应式为
您最近一年使用:0次
名校
解题方法
2 . 阳极泥是电解精炼铜过程中产出的一种副产品,其中含Au、Pt、Ag、Cu和CuAgSe等。半湿法处理铜阳极泥回收贵金属银、铂、金的工艺如下图:

已知:①“焙烧除硒”过程中硒、铜和银转化为相应的氧化物;②“分银”工艺中银转化为[Ag(NH3)2]+。
回答下列问题:
(1)硒(34Se)位于元素周期表的第四周期第ⅥA族,其原子结构示意图为_______ ;CuAgSe中铜的化合价为_______ 。
(2)有利于“焙烧除硒”的措施有适当提高焙烧温度、_______ (提出一种措施)。
(3)“脱铜”工艺中,与银元素相关的离子反应方程式为_______ 。
(4)“分银”得到滤渣的主要成分有Pt和_______ 。
(5)“沉银”过程中肼(N2H4)的作用是_______ 。
(6)经上述工艺得到的粗银还需进行电解精炼:纯银作阴极,电解液为硝酸和硝酸银的混合溶液。硝酸浓度不能过大,可能的原因是_______ (用化学语言解释)。
(7)某研究性学习小组为探究Ag 与Fe3+的反应,按图装置进行实验(盐桥中的物质不参与反应)。

①K闭合时,电流表指针偏转,石墨作_______ (填“正极”或“负极”)。
②当指针归零后,向U形管左侧滴加几滴Fe(NO3)2浓溶液,发现指针向反方向偏转,写出此时银电极的反应式:_______ 。
③结合上述实验分析,写出Fe3+和Ag反应的离子方程式:_______ 。

已知:①“焙烧除硒”过程中硒、铜和银转化为相应的氧化物;②“分银”工艺中银转化为[Ag(NH3)2]+。
回答下列问题:
(1)硒(34Se)位于元素周期表的第四周期第ⅥA族,其原子结构示意图为
(2)有利于“焙烧除硒”的措施有适当提高焙烧温度、
(3)“脱铜”工艺中,与银元素相关的离子反应方程式为
(4)“分银”得到滤渣的主要成分有Pt和
(5)“沉银”过程中肼(N2H4)的作用是
(6)经上述工艺得到的粗银还需进行电解精炼:纯银作阴极,电解液为硝酸和硝酸银的混合溶液。硝酸浓度不能过大,可能的原因是
(7)某研究性学习小组为探究Ag 与Fe3+的反应,按图装置进行实验(盐桥中的物质不参与反应)。

①K闭合时,电流表指针偏转,石墨作
②当指针归零后,向U形管左侧滴加几滴Fe(NO3)2浓溶液,发现指针向反方向偏转,写出此时银电极的反应式:
③结合上述实验分析,写出Fe3+和Ag反应的离子方程式:
您最近一年使用:0次
3 . 科学家设计了一种将苯酚(C6H5OH)氧化为CO2和H2O的原电池-电解池组合装置如图所示,已知羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。下列说法错误的是
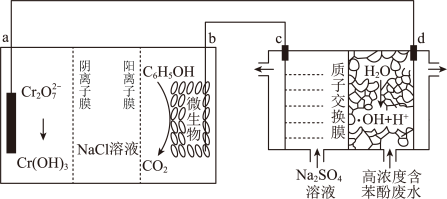

| A.高温下不利于该电池的使用 |
| B.电池工作一段时间后, NaCl溶液浓度将降低 |
| C.d电极的电极反应为:H2O-e-=·OH+H+ |
| D.相同时间内,c、d两极产生气体的体积比(相同条件下)为3:7 |
您最近一年使用:0次
名校
解题方法
4 . 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
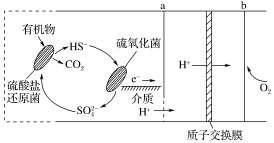

A.HS-转化为 的反应为HS-+4H2O-8e-= 的反应为HS-+4H2O-8e-= +9H+ +9H+ |
| B.电极b是该电池的正极,发生氧化反应 |
| C.电子从电极b流出,经外电路流向电极a |
| D.若外电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜 |
您最近一年使用:0次
2021-07-23更新
|
1847次组卷
|
3卷引用:四川省内江市第六中学2022-2023学年高一下学期期中考试化学试题
5 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
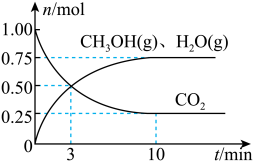
①从反应开始到平衡,氢气的平均反应速率v(H2)=________ 。
②下列措施一定不能使CO2的平衡转化率增大的是________ 。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
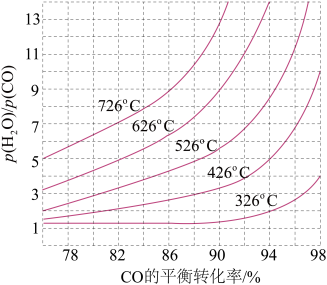
①上述反应的正反应方向是________ 反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____ (填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________ 。
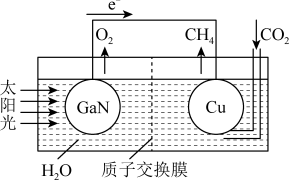
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定不能使CO2的平衡转化率增大的是
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)
 H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
①上述反应的正反应方向是
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是

A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
您最近一年使用:0次
2019-06-18更新
|
1201次组卷
|
4卷引用:四川省泸州市泸县第二中学2020届高三上学期期中考试理综化学试题
四川省泸州市泸县第二中学2020届高三上学期期中考试理综化学试题【市级联考】辽宁省兴城市2019届高三第九次模拟考试理科综合化学试题山东省济南二中2020届高三线上检测化学试题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题



