解题方法
1 . 一种锂电池放电时的工作原理如图所示,总反应为 。该电池以
。该电池以 熔融盐为电解质,
熔融盐为电解质, 的熔点为1567℃,下列说法正确的是
的熔点为1567℃,下列说法正确的是
 。该电池以
。该电池以 熔融盐为电解质,
熔融盐为电解质, 的熔点为1567℃,下列说法正确的是
的熔点为1567℃,下列说法正确的是
| A.Li电极发生还原反应 |
| B.电子由Ni经辅助电极流向Li |
C.正极的电极反应: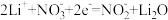 |
| D.放电时,Li电极质量增加 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题。
(1)理论上不能设计为原电池的化学反应是___________ 。
a.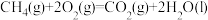
b.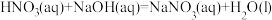
c.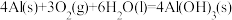
d.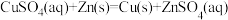
(2)某小组为探究 与
与 能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和 溶液的琼脂)。该装置石墨棒上发生的电极反应式为
溶液的琼脂)。该装置石墨棒上发生的电极反应式为___________ ,盐桥中 向
向___________ 烧杯移动(填“甲”或“乙”)。___________ ,B电极的电极反应方程式为___________ 。 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式___________ 。
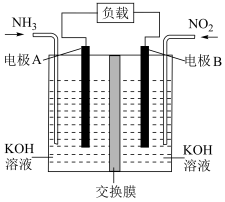
(5)汽车尾气中含有的 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气史
传感器可监测汽车尾气史 含量,其工作原理如图所示:
含量,其工作原理如图所示: 电极为
电极为___________ (填“正极”或“负极), 电极上发生的电极反应式为
电极上发生的电极反应式为___________ 。
(1)理论上不能设计为原电池的化学反应是
a.
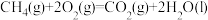
b.
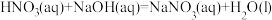
c.
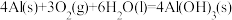
d.
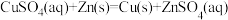
(2)某小组为探究
 与
与 能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和 溶液的琼脂)。该装置石墨棒上发生的电极反应式为
溶液的琼脂)。该装置石墨棒上发生的电极反应式为 向
向
 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式(5)汽车尾气中含有的
 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气史
传感器可监测汽车尾气史 含量,其工作原理如图所示:
含量,其工作原理如图所示:
 电极为
电极为 电极上发生的电极反应式为
电极上发生的电极反应式为
您最近一年使用:0次
3 . 一种在室温下可循环充放电的新型纤维 电池有望应用于可穿戴设备的储能,其工作原理为:
电池有望应用于可穿戴设备的储能,其工作原理为: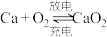 ,放电时
,放电时
 电池有望应用于可穿戴设备的储能,其工作原理为:
电池有望应用于可穿戴设备的储能,其工作原理为: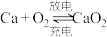 ,放电时
,放电时A. 发生还原反应 发生还原反应 | B. 在正极失电子 在正极失电子 |
| C.阳离子由正极移向负极 | D.每消耗 ,转移 ,转移 电子 电子 |
您最近一年使用:0次
名校
解题方法
4 . 一种向外输出电能的同时,又能使水土中重金属离子Cd2+变成沉淀而被除去的电化学装置,其工作原理如图所示,下列说法正确的是
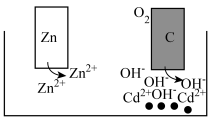

| A.锌棒为该装置的正极 |
| B.电子从锌棒经水土移向碳棒 |
| C.碳棒附近Cd2+转化为Cd而被除去 |
| D.标准状况下,每消耗22.4 LO2,理论上最多能除去2 mol Cd2+ |
您最近一年使用:0次
2023-09-08更新
|
319次组卷
|
3卷引用:广东省广州市第六中学2024届高中毕业班第一次调研考试化学试题
解题方法
5 . 原电池是直接把化学能转化为电能的装置。
(1)某研究性学习小组的同学对 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和 溶液,起到连通电路的作用)。
溶液,起到连通电路的作用)。
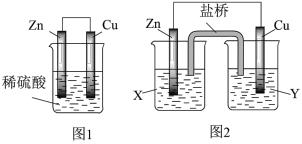
①实验表明,图1中锌电极为_____ 极(填写“正”或“负”),电极反应为:_____ 。
②图2中实验过程中只有 极上产生气泡,则X是
极上产生气泡,则X是_____ 溶液,正极的电极反应式为_____ 。
(2)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为: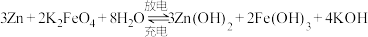
①放电时,正极反应为_____ 。
②放电时,_____ (填“正”或“负”)极附近溶液的碱性增强。
(3)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子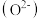 在其间通过。如图所示,其中多孔电极不参与电极反应。写出该电池的负极电极反应式:
在其间通过。如图所示,其中多孔电极不参与电极反应。写出该电池的负极电极反应式:_____ 。

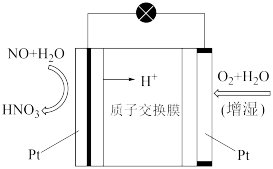
(4)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:_____ ,若过程中产生 ,则消耗标准状况下
,则消耗标准状况下 的体积为
的体积为_____ L。
(1)某研究性学习小组的同学对
 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和 溶液,起到连通电路的作用)。
溶液,起到连通电路的作用)。
①实验表明,图1中锌电极为
②图2中实验过程中只有
 极上产生气泡,则X是
极上产生气泡,则X是(2)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:
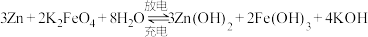
①放电时,正极反应为
②放电时,
(3)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子
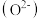 在其间通过。如图所示,其中多孔电极不参与电极反应。写出该电池的负极电极反应式:
在其间通过。如图所示,其中多孔电极不参与电极反应。写出该电池的负极电极反应式:
(4)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:
 ,则消耗标准状况下
,则消耗标准状况下 的体积为
的体积为
您最近一年使用:0次
名校
解题方法
6 . 利用原电池原理可以避免金属腐蚀,某小组同学设计了如下图所示的实验方案来探究铁片的腐蚀情况。下列说法中正确的是
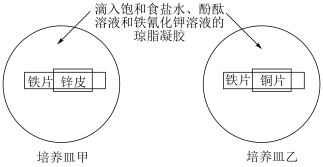

| A.甲中的铁片附近会出现蓝色 |
| B.甲中形成了原电池,锌片作正极 |
| C.乙中铜片附近会出现红色 |
| D.乙中的铜片上发生氧化反应 |
您最近一年使用:0次
2023-05-22更新
|
633次组卷
|
3卷引用:广东省仲元中学2023-2024学年高三上学期模拟测试(一)化学试题
名校
解题方法
7 . 科学家研发了一种以Al和Pd@石墨烯为电极的Al- 电池,电池以
电池,电池以 离子液体作电解质,放电时在提供能量的同时实现了人工固氮,示意图如下。下列说法不正确的是
离子液体作电解质,放电时在提供能量的同时实现了人工固氮,示意图如下。下列说法不正确的是
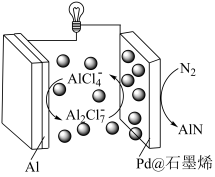
 电池,电池以
电池,电池以 离子液体作电解质,放电时在提供能量的同时实现了人工固氮,示意图如下。下列说法不正确的是
离子液体作电解质,放电时在提供能量的同时实现了人工固氮,示意图如下。下列说法不正确的是
| A.充电时Al电极是阴极 |
B.放电时 离子浓度增大, 离子浓度增大, 离子浓度减少 离子浓度减少 |
C.放电时正极反应为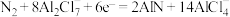 |
D.放电时电路中每通过6mol  ,电池总质量理论上增加28g ,电池总质量理论上增加28g |
您最近一年使用:0次
2023-04-19更新
|
1521次组卷
|
4卷引用:广东省广州市2023届高三二模考试化学试题
广东省广州市2023届高三二模考试化学试题(已下线)2023年广东卷高考真题变式题(选择题6-10)广东省肇庆市德庆县香山中学2023-2024学年高三上学期9月月考化学试题河南省信阳高级中学2023-2024学年高二上学期元旦测试化学试题
名校
8 . 回答下列问题
(1)依据反应: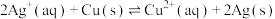 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
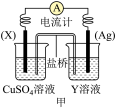
①电极 的材料是
的材料是_______ ;Y溶液可以是_______ ;
②银电极上发生的电极反应式是_______ , 电极上发生的电极反应为
电极上发生的电极反应为_______ 反应(填“氧化”或“还原”);外电路中的电子_______ (填“流出”或“流向”)Ag电极。
(2)次磷酸 是一种精细化工产品,已知
是一种精细化工产品,已知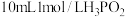 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:
①次磷酸 属于
属于_______ (填“一元酸”“二元酸”或“无法确定”)。
②设计实验方案,证明次磷酸是弱酸:_______ 。
(3)某课外兴趣小组用 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
①该小组同学选用酚酞做指示剂,滴定终点的现象为_______ 。
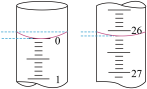
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为_______  。
。
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是_______
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
(1)依据反应:
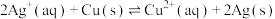 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
①电极
 的材料是
的材料是②银电极上发生的电极反应式是
 电极上发生的电极反应为
电极上发生的电极反应为(2)次磷酸
 是一种精细化工产品,已知
是一种精细化工产品,已知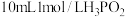 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:①次磷酸
 属于
属于②设计实验方案,证明次磷酸是弱酸:
(3)某课外兴趣小组用
 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。①该小组同学选用酚酞做指示剂,滴定终点的现象为
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为
 。
。
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
您最近一年使用:0次
2023-01-08更新
|
179次组卷
|
2卷引用:广东省广州中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 近日“宁德时代”宣布2023年实现钠离子电池产业化,钠离子电池以其低成本、高安全性及其优异电化学属性等成为锂离子电池的首选“备胎”,其充放电过程是 在正负极间的镶嵌与脱嵌。下列说法
在正负极间的镶嵌与脱嵌。下列说法不正确 的是
 在正负极间的镶嵌与脱嵌。下列说法
在正负极间的镶嵌与脱嵌。下列说法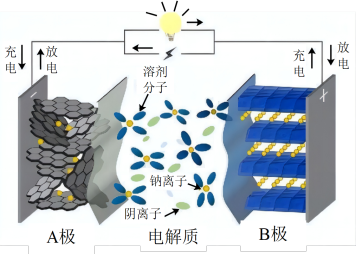
| A.放电时负极区钠单质失去电子 |
B.充电时 由“B极”向“A极”移动 由“B极”向“A极”移动 |
| C.由于未使用稀缺的锂钴元素,量产后该电池生产成本比锂离子电池低 |
D.该电池一种正极材料为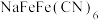 ,充电时的电极反应为: ,充电时的电极反应为: |
您最近一年使用:0次
2022-08-08更新
|
2705次组卷
|
11卷引用:广东省广州市六校2023届高三上学期8月第一次联考化学试题
广东省广州市六校2023届高三上学期8月第一次联考化学试题广东省六校2023届高三第一次联考化学试题福建省三明第一中学2022-2023学年高三上学期第二次月考化学试题(已下线)热点情景汇编-专题八 化学反应中的电能(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)T12-电化学原理(已下线)T10-电化学原理广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷
名校
10 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
您最近一年使用:0次



