名校
解题方法
1 . 将CO合成甲醇是实现“碳达峰、碳中和”的一项重要措施,在此过程中可能涉及以下物质:
①H2②O2③CO④He⑤H2O2⑥Na2O2⑦KOH⑧CH3OH⑨K2CO3
请判断:
(1)含有极性共价键的离子化合物有___________ (填编号)。
(2)含有非极性共价键的共价化合物有___________ (填编号)。
(3)在实验室中模拟CO合成甲醇的反应,在2L密闭容器内,400℃时发生反应:CO(g)+2H2(g)⇌CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
已知每生成1molCH3OH(g),放出的热量为116kJ。计算上述反应达到平衡时放出的热量Q=___________ kJ(保留2位有效数字)。
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O。则电池放电时通入空气的电极为
+6H2O。则电池放电时通入空气的电极为___________ (“正”或“负”)极;从电极反应来看,每消耗1molCH3OH转移的电子数为___________ NA。
①H2②O2③CO④He⑤H2O2⑥Na2O2⑦KOH⑧CH3OH⑨K2CO3
请判断:
(1)含有极性共价键的离子化合物有
(2)含有非极性共价键的共价化合物有
(3)在实验室中模拟CO合成甲醇的反应,在2L密闭容器内,400℃时发生反应:CO(g)+2H2(g)⇌CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2
 +6H2O。则电池放电时通入空气的电极为
+6H2O。则电池放电时通入空气的电极为
您最近一年使用:0次
2023-08-10更新
|
230次组卷
|
2卷引用:山东省菏泽市定陶区第一中学2023-2024学年高一下学期第一次月考化学试题
名校
2 . 人们应用原电池原理制作了多种电池,以满足不同的需要。以下是几种不同形式的原电池装置,请根据题中提供的信息,填写空格。
(1)某原电池的装置如图1所示。若需将反应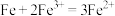 设计成如图1所示的原电池装置,则A(负极)极材料为
设计成如图1所示的原电池装置,则A(负极)极材料为______________ (填化学式),B(正极)极的电极反应式为_____________________________ ,溶液C为______________ 。
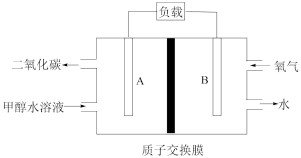
(3)甲醇是重要的化工原料,又可作为燃料使用,用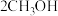 和
和 组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为
组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为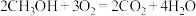 ,则a处充入的是
,则a处充入的是______ (填化学式),电极c的电极反应式为___________ ;若线路中转移3mol电子,则上述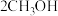 燃料电池消耗的
燃料电池消耗的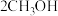 的质量为
的质量为________ g。
(1)某原电池的装置如图1所示。若需将反应
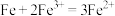 设计成如图1所示的原电池装置,则A(负极)极材料为
设计成如图1所示的原电池装置,则A(负极)极材料为

A.盐桥中的阴离子向 溶液移动 溶液移动 | B.电子流动方向为Zn→盐桥→Cu |
| C.铜片作电池的正极 | D.该电池比单液原电池的电流更稳定 |
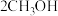 和
和 组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为
组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为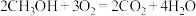 ,则a处充入的是
,则a处充入的是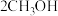 燃料电池消耗的
燃料电池消耗的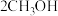 的质量为
的质量为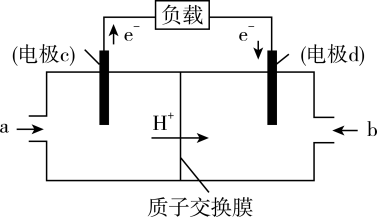
您最近一年使用:0次
2023-07-21更新
|
167次组卷
|
3卷引用:综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)辽宁省朝阳市建平县实验中学2022-2023学年高一下学期7月期末化学试题辽宁省本溪市第一中学2023-2024学年高二上学期11月期中考试化学试题
解题方法
3 . 甲醇 是一种重要的化工原料和新型燃料。甲醇、空气和
是一种重要的化工原料和新型燃料。甲醇、空气和 溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
 是一种重要的化工原料和新型燃料。甲醇、空气和
是一种重要的化工原料和新型燃料。甲醇、空气和 溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
A. 为电源的负极 为电源的负极 |
B. 电极反应式为 电极反应式为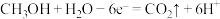 |
C. 极每消耗 极每消耗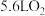 ,电路中则转移 ,电路中则转移 电子 电子 |
D.电池工作一段时间后,电解质溶液的 值变小 值变小 |
您最近一年使用:0次
名校
4 . 甲醇(CH3OH)燃料电池的工作原理如图甲所示,回答下列问题:

(1)该电池工作时,b口通入的物质为________ (填化学式,下同),c口通入的物质为________ 。
(2)该电池负极的电极反应式为________ 。
(3)精炼铜时,粗铜应与甲醇燃料电池的________ (填“正”或“负”)极相连,阴极的电极反应式为________ ,电解质溶液为________ 。
(4)以该燃料电池作电源,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊(如图乙),原因是:________ (用相关的电极反应式表示)。

(1)该电池工作时,b口通入的物质为
(2)该电池负极的电极反应式为
(3)精炼铜时,粗铜应与甲醇燃料电池的
(4)以该燃料电池作电源,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊(如图乙),原因是:
您最近一年使用:0次
2021-12-21更新
|
254次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题
名校
解题方法
5 . 根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极上发生的反应为。
A. |
B.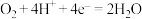 |
C. |
D. |
您最近一年使用:0次
2021-12-02更新
|
1323次组卷
|
10卷引用:河南省郑州市登封市第一高级中学2023-2024学年高二上学期期末考试化学试题
河南省郑州市登封市第一高级中学2023-2024学年高二上学期期末考试化学试题人教2019版选择性必修一第四章 第一节 原电池 课后习题(已下线)4.1.2 化学电源-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)押广东卷化学第9题 原电池-备战2022年高考化学临考题号押题(广东卷)(已下线)第29讲 第四章《化学反应与电能》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题宁夏中卫市中宁县2022-2023学年高二上学期质量测查(期末)化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷新疆哈密市第八中学2022-2023学年高二上学期期末考试化学试题内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期第三次考试化学试卷
名校
6 . 化学电源在日常生活和工业生产中有着重要的应用。如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:___________ 。
(2)C极的电极反应式为___________ 。
(3)若有2.24 L(标准状况下)氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L(标准状况下);丙装置中阴极析出铜的质量为___________ g。
(4)“新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的___________ 极,电解池中生成N2O5的电极反应式为___________ 。
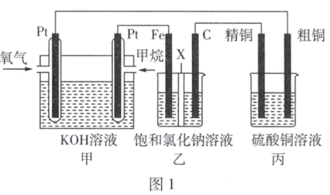
(2)C极的电极反应式为
(3)若有2.24 L(标准状况下)氧气参加反应,则乙装置中铁极上生成的气体体积为
(4)“新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的
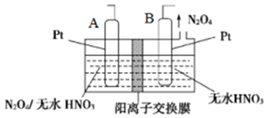
您最近一年使用:0次
2021-10-27更新
|
94次组卷
|
2卷引用:河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题
名校
解题方法
7 . 甲醇( )的合成与应用具有广阔的发展前景。
)的合成与应用具有广阔的发展前景。
(1)工业上通过 和
和 化合来制备
化合来制备 :
:
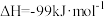 ,若将
,若将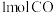 和
和 混合后充分反应,放出的热量
混合后充分反应,放出的热量_______ (填“大于”、“等于”或“小于”)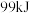 。
。
(2)工业上还可以通过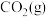 与
与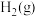 反应制备
反应制备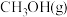 :
:
 。
。
①保持温度不变,向 恒容密闭容器中充入
恒容密闭容器中充入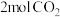 和
和 ,能说明该反应已达平衡状态的是
,能说明该反应已达平衡状态的是_______ (填字母)。
a.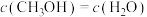 b.
b.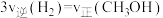 c.容器内压强保持不变
c.容器内压强保持不变
②在 恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
 内的平均反应速率
内的平均反应速率
_______ 。反应达平衡时,
_______ 。
③向恒容密闭容器中充入一定量CO2和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是_______ 。_______ (填“A”或“B”)极区移动。
②线路中通过1mol电子时,B区生成水的质量为_______  。
。
 )的合成与应用具有广阔的发展前景。
)的合成与应用具有广阔的发展前景。(1)工业上通过
 和
和 化合来制备
化合来制备 :
:
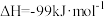 ,若将
,若将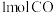 和
和 混合后充分反应,放出的热量
混合后充分反应,放出的热量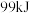 。
。(2)工业上还可以通过
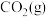 与
与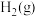 反应制备
反应制备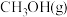 :
:
 。
。①保持温度不变,向
 恒容密闭容器中充入
恒容密闭容器中充入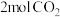 和
和 ,能说明该反应已达平衡状态的是
,能说明该反应已达平衡状态的是a.
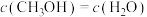 b.
b.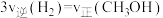 c.容器内压强保持不变
c.容器内压强保持不变②在
 恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:| 反应时间 | 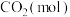 |  | 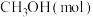 |
 | 2 | 6 | 0 |
 | 1 | ||
 | 1.5 | ||
 | 1.5 |
 内的平均反应速率
内的平均反应速率

③向恒容密闭容器中充入一定量CO2和
 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),CO2的转化率随反应温度的变化如图所示。其中a点CO2的转化率高于b点的原因是
②线路中通过1mol电子时,B区生成水的质量为
 。
。
您最近一年使用:0次
2021-07-07更新
|
414次组卷
|
6卷引用:重难点01 化学反应速率的计算及平衡图像分析-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
(已下线)重难点01 化学反应速率的计算及平衡图像分析-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)江苏省徐州市2020-2021学年高一下学期期末抽测化学试题江苏省徐州市第七中学2021-2022学年高一下学期4月学情调研化学试题江苏省泰州中学2022-2023学年高一下学期期中考试化学试题江苏省徐州市第一中学2022-2023学年高一下学期期中考试化学试题江苏省响水中学2022-2023学年高一下学期7月学情调研考试化学试题
真题
名校
8 . 以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
| A.放电过程中,K+均向负极移动 |
| B.放电过程中,KOH物质的量均减小 |
| C.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 |
| D.消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L |
您最近一年使用:0次
2021-06-29更新
|
9507次组卷
|
26卷引用:山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期元旦竞赛考试化学试题
山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期元旦竞赛考试化学试题2021年新高考山东化学高考真题(已下线)课时30 新型原电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题08 电化学及其应用-备战2022年高考化学真题及地市好题专项集训【山东专用】黑龙江省哈尔滨市第三中学2021-2022学年高二上学期10月阶段性测试化学试题2021年山东高考化学试题变式题1-10(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷12题 电化学基础-备战2022年高考化学临考题号押题(新高考通版)第四章 综合拔高练(已下线)第16讲 原电池 新型电源 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题05 化学能与电能的转化(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第六章 化学反应与能量 第35讲 原电池 化学电源(已下线)专题二 燃料电池(练习)(已下线)题型17 燃料电池的应用山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题章末检测卷(四) 化学反应与电能(已下线)考点18 原电池 化学电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 原电池 化学电源(已下线)考点2 原电池 新型电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题
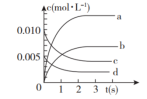
9 . 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
(1)图中表示CH3OH的浓度变化的曲线是_______ (填字母)。_______ 。随着反应的进行,该反应的速率逐渐减慢的原因是_______ 。
(3)该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量_______ 形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。
(4)已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=
CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=_______ kJ。
(5)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O
+6H2O
则电池放电时通入空气的电极为_______ (“正”或“负”)极;从电极反应来看,每消耗1 mol CH3OH转移_______ mol电子。
 CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(3)该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量
(4)已知在400℃时,反应CO(g)+2H2(g)
 CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=
CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=(5)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2
 +6H2O
+6H2O则电池放电时通入空气的电极为
您最近一年使用:0次
2021-06-15更新
|
422次组卷
|
3卷引用:重难点01 热能与电能综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)
(已下线)重难点01 热能与电能综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)山东省临沂市兰陵县2020-2021学年高一下学期期中教学质量检测化学试题北京市第二十中学2020-2021学年高一下学期期末考试化学试题
名校
解题方法
10 . 氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确 的是
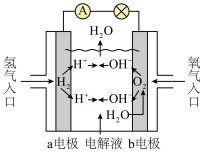
| A.氢氧燃料电池中,当转移4 mol电子时消耗2 mol氢气 |
| B.电子从a电极经外电路流向b电极 |
| C.供电时的总反应为:2H2 + O2 = 2H2O |
| D.甲烷燃料电池中,通入氧气的一极为负极 |
您最近一年使用:0次
2021-05-06更新
|
327次组卷
|
2卷引用:北京市第三中学2023-2024学年高一下学期期中考试化学试题



