解题方法
1 . 制造尼龙—66的原料己二腈NC(CH2)4CN,传统上以乙炔和甲醛为原料经过很长路线才能合成。近年来将丙烯氰电解阴极加氢生成己二腈的电有机合成法在工业化生产中已经非常成熟。其总反应为:4CH2=CHCN+2H2O=2NC(CH2)4CN+O2↑。下列说法不正确的是
| A.若电解过程有1mol电子转移,理论上阳极生成0.25mol气体 |
| B.阳极电极反应式为:2CH2=CHCN+2H++2e-=NC(CH2)4CN |
| C.很多不能自发进行的氧化还原反应可以通过电解法来实现 |
| D.与传统有机合成相比,电有机合成法反应条件温和、反应试剂纯净且生产效率高 |
您最近一年使用:0次
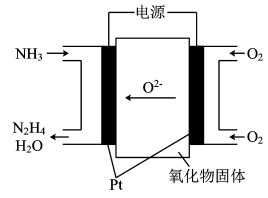
2 . (1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为___________ ,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应式_________ ;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________ 。
(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:________________ 。
②乙装置中石墨电极产生产物如何检验______ ,电解一段时间后,乙池中的溶液呈___ 性。
③图中用丙装置模拟工业中的________ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_____ g。

(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:
②乙装置中石墨电极产生产物如何检验
③图中用丙装置模拟工业中的
您最近一年使用:0次
解题方法
3 . 近日,清华大学某团队设计出了一种双极性膜(将 解离成
解离成 和
和 )电解合成
)电解合成 反应器,简化模型如图所示,下列说法错误的是
反应器,简化模型如图所示,下列说法错误的是
 解离成
解离成 和
和 )电解合成
)电解合成 反应器,简化模型如图所示,下列说法错误的是
反应器,简化模型如图所示,下列说法错误的是
| A.电极a的电势小于电极b的电势 |
B.通电时双极性膜将水解离为 和 和 , , 向阴极方向移动 向阴极方向移动 |
C.阴极的电极反应式为 |
| D.维持电流强度0.5A,电池工作5min,理论上产生约0.012L气体(已折算成标准状况下) |
您最近一年使用:0次
名校
4 . 近期,天津大学化学团队以 与辛胺为原料实现了甲酸和辛腈的高选择性合成,工作原理如图。下列说法
与辛胺为原料实现了甲酸和辛腈的高选择性合成,工作原理如图。下列说法错误 的是
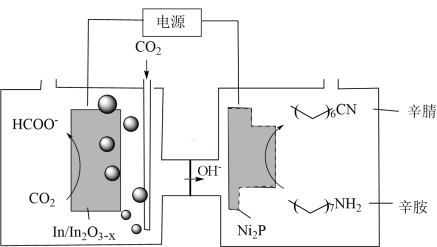
 与辛胺为原料实现了甲酸和辛腈的高选择性合成,工作原理如图。下列说法
与辛胺为原料实现了甲酸和辛腈的高选择性合成,工作原理如图。下列说法
A. 电极与电源正极相连 电极与电源正极相连 |
B. 电极上可能有副产物 电极上可能有副产物 生成 生成 |
C.在 电极上发生的反应为: 电极上发生的反应为: |
D.标准状况下 参与反应时溶液中有 参与反应时溶液中有 移向 移向 电极 电极 |
您最近一年使用:0次
5 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)电解法制氨。
如图所示的电解池电解 溶液可制得氨。工作时,
溶液可制得氨。工作时, 在双极膜(由阴、阳离子膜复合而成)界面处解离成
在双极膜(由阴、阳离子膜复合而成)界面处解离成 和
和 ,分别通过阴、阳离子膜分别进入两侧极室。
,分别通过阴、阳离子膜分别进入两侧极室。

①进入a极室的离子是___________ (填“ ”或“
”或“ ”)。
”)。
②产生 的电极反应式为
的电极反应式为___________ 。
③电解池工作时,在电极b可得到副产品___________ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
Ⅰ. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。

①总反应的速率取决于第___________ 步。
② 反应的
反应的
___________ (用图中能量数据表示)。
(3)氨氮的去除。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。
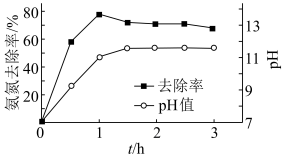
①电解时两极反应式分别为: ,
,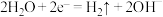 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②反应 以后,氨氮去除率随时间的延长反而下降的原因是
以后,氨氮去除率随时间的延长反而下降的原因是___________ 。
(1)电解法制氨。
如图所示的电解池电解
 溶液可制得氨。工作时,
溶液可制得氨。工作时, 在双极膜(由阴、阳离子膜复合而成)界面处解离成
在双极膜(由阴、阳离子膜复合而成)界面处解离成 和
和 ,分别通过阴、阳离子膜分别进入两侧极室。
,分别通过阴、阳离子膜分别进入两侧极室。
①进入a极室的离子是
 ”或“
”或“ ”)。
”)。②产生
 的电极反应式为
的电极反应式为③电解池工作时,在电极b可得到副产品
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:Ⅰ.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

①总反应的速率取决于第
②
 反应的
反应的
(3)氨氮的去除。
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。
①电解时两极反应式分别为:
 ,
,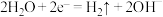 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:②反应
 以后,氨氮去除率随时间的延长反而下降的原因是
以后,氨氮去除率随时间的延长反而下降的原因是
您最近一年使用:0次
2024-02-04更新
|
100次组卷
|
2卷引用:江苏省盐城市五校联考2023-2024学年高二下学期3月第一次学情调研检测化学试题
6 . 研究 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。
Ⅰ.人类活动排放过量的 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
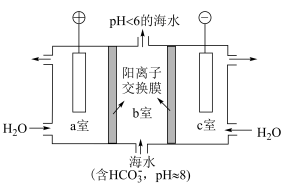
(1)c室发生的电极反应式为________ 。
(2)a室产生的______ 透过离子交换膜进入b室,与b室中的 发生反应,离子方程式为
发生反应,离子方程式为________ 。
Ⅱ. 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:
反应①:
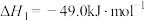
反应②:
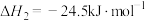
反应③:
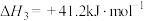
(3)写出 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:________ 。
(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
(5)在恒压、 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。

 的选择性
的选择性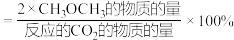 。
。
关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
(6)一定温度下,向容积为2L的恒容密闭容器中充入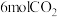 和
和 ,仅发生反应Ⅰ:
,仅发生反应Ⅰ:
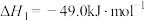 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。Ⅰ.人类活动排放过量的
 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
(1)c室发生的电极反应式为
(2)a室产生的
 发生反应,离子方程式为
发生反应,离子方程式为Ⅱ.
 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:反应①:

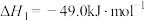
反应②:

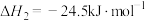
反应③:

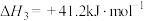
(3)写出
 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
(5)在恒压、
 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
 的选择性
的选择性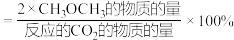 。
。关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
A.反应④在A点和B点时的化学平衡常数: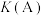 小于 小于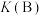 |
B.当温度、压强一定时,在原料气( 和 和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低 |
| D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键 |
(6)一定温度下,向容积为2L的恒容密闭容器中充入
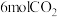 和
和 ,仅发生反应Ⅰ:
,仅发生反应Ⅰ:
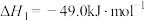 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
A.该反应在0~8min内 的平均反应速率是 的平均反应速率是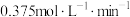 |
| B.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
C.保持温度不变,若起始时向上述容器中充入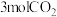 和 和 ,则平衡时 ,则平衡时 的体积分数等于20% 的体积分数等于20% |
D.保持温度不变,若起始时向上述容器中充入 、 、 、 、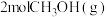 和 和 ,则此时反应向正反应方向进行。 ,则此时反应向正反应方向进行。 |
您最近一年使用:0次
名校
7 . 电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:
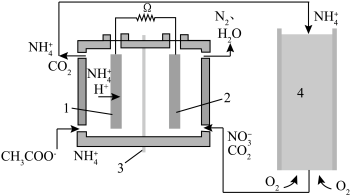
(1)电极2名称:___________ 极,电池工作一段时间后,电极2附近的pH___________ (填“增大”“减小”或“不变”)。
(2)在好氧微生物反应器中发生的反应方程式___________ 。
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为___________ mol。
II.次磷酸钴(II)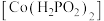 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
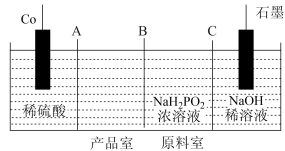
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是___________ 。
(5)石墨电极每生成1molH2时,___________ 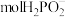 向
向___________ 迁移(填“阴极室”“阳极室”或“产品室”)。
(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为___________ 。
(7)用 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为___________ 。
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:

(1)电极2名称:
(2)在好氧微生物反应器中发生的反应方程式
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为
II.次磷酸钴(II)
 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是
(5)石墨电极每生成1molH2时,
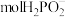 向
向(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为
(7)用
 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
解题方法
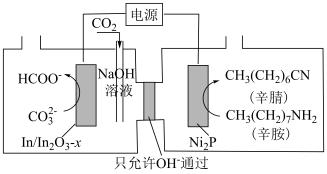
8 . 研究表明,以辛胺[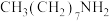 ]和
]和 为原料高选择性地合成辛腈[
为原料高选择性地合成辛腈[ ]和甲酸盐的工作原理如图,下列说法不正确的是
]和甲酸盐的工作原理如图,下列说法不正确的是
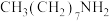 ]和
]和 为原料高选择性地合成辛腈[
为原料高选择性地合成辛腈[ ]和甲酸盐的工作原理如图,下列说法不正确的是
]和甲酸盐的工作原理如图,下列说法不正确的是
A.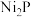 电极与电源正极相连 电极与电源正极相连 |
B.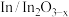 电极上可能有副产物 电极上可能有副产物 生成 生成 |
C.在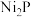 电极上发生的反应为: 电极上发生的反应为: |
D.电路中转移 电子时,阴极区溶液质量增加 电子时,阴极区溶液质量增加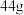 (不考虑气体的溶解) (不考虑气体的溶解) |
您最近一年使用:0次
2023-12-14更新
|
189次组卷
|
2卷引用:江苏省常熟市2023-2024学年高三上学期阶段性抽测二化学试卷
名校
9 . 尿素[CO(NH2)2]合成方法的发展体现了化学科学与技术的不断进步。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为___________ ,尿素中碳原子的杂化轨道类型为___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。
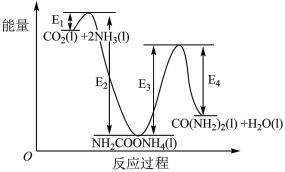
结合反应过程中能量变化示意图,下列说法正确的是___________ (填字母)。
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。

①电解池中电极X应接直流电源的___________ 极。
②电解过程中生成尿素的电极反应式是___________ 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c( )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
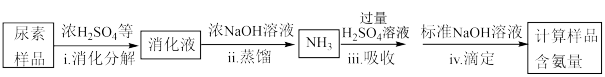
①消化液中的含氮粒子是___________ 。
②下列装置,可以完成蒸馏操作的是___________ (填字母)。
A. B.
B. 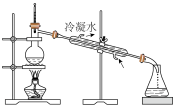 C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
①电解池中电极X应接直流电源的
②电解过程中生成尿素的电极反应式是
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c(
 )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
①消化液中的含氮粒子是
②下列装置,可以完成蒸馏操作的是
A.
 B.
B.  C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
您最近一年使用:0次
2023-11-30更新
|
192次组卷
|
2卷引用:河北衡水中学2023-2024学年高三上学期三调考试化学试题
名校
解题方法
10 . 碲碳酸铝[Al2(CO2Te)3]可提供首例双阴离子配体。以铝土矿(主要成分是Al2O3,含Fe2O3、MgO、SiO2等杂质)为原料制备碲碳酸铝的流程如图:

下列叙述错误的是

下列叙述错误的是
| A.滤渣2主要成分是Fe(OH)3和Mg(OH)2 |
| B.“电解”中,转移3 mol e⁻理论上阴极析出27 g Al |
| C.“沉铝”中气体X为氨气 |
| D.“合成”中理论上消耗Al2Te3和CO2的物质的量之比为1:3 |
您最近一年使用:0次
2023-10-27更新
|
413次组卷
|
3卷引用:河南省禹州市高级中学菁华校区2023-2024学年高三上学期第三次阶段考试理综试题



