名校
解题方法
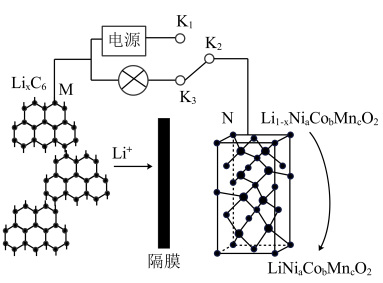
1 . 目前的新能源汽车多采用三元锂电池,某三元锂电池工作原理如图所示,该电池离子导体为有机锂盐溶液。
(1)锂离子电池的电极材料为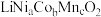 ,当
,当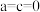 且
且 时该物质中Co元素的化合价为
时该物质中Co元素的化合价为_____________ , 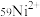 的中子数为31,1mol
的中子数为31,1mol 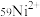 含有电子
含有电子_____________ mol。
(2)连接 、
、 时,N为
时,N为_____________ 极,电极电势高的电极发生_____________ (填“氧化”或“还原”)反应,被氧化的物质为_____________ (填化学式)。
(3)连接 、
、 时,N极的电极反应式为
时,N极的电极反应式为__________________ ,当外电路通过0.1mol电子时,通过隔膜的 质量为
质量为______ g。
(1)锂离子电池的电极材料为
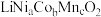 ,当
,当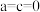 且
且 时该物质中Co元素的化合价为
时该物质中Co元素的化合价为 的中子数为31,1mol
的中子数为31,1mol 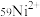 含有电子
含有电子(2)连接
 、
、 时,N为
时,N为(3)连接
 、
、 时,N极的电极反应式为
时,N极的电极反应式为 质量为
质量为
您最近半年使用:0次
2023-05-07更新
|
218次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一下学期期中考试化学试题
名校
解题方法
2 . 我国科学家发现,将纳米级 嵌入电极材料,能大大提高可充电铝离子电池的容量。其中有机离子导体主要含
嵌入电极材料,能大大提高可充电铝离子电池的容量。其中有机离子导体主要含 和
和 ,隔膜仅允许含铝元素的微粒通过,放电时
,隔膜仅允许含铝元素的微粒通过,放电时 嵌入电极得到
嵌入电极得到 。下列说法正确的是
。下列说法正确的是
 嵌入电极材料,能大大提高可充电铝离子电池的容量。其中有机离子导体主要含
嵌入电极材料,能大大提高可充电铝离子电池的容量。其中有机离子导体主要含 和
和 ,隔膜仅允许含铝元素的微粒通过,放电时
,隔膜仅允许含铝元素的微粒通过,放电时 嵌入电极得到
嵌入电极得到 。下列说法正确的是
。下列说法正确的是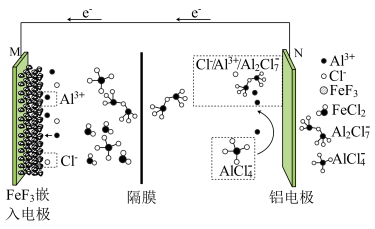
| A.放电时,N电极发生氧化反应 |
B.放电时,正极反应为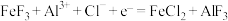 |
C.充电时, 离子由右侧移向左侧电极室 离子由右侧移向左侧电极室 |
D.充电时,阳极反应为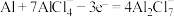 |
您最近半年使用:0次
2023-05-07更新
|
159次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一下学期期中考试化学试题
名校
3 . Ⅰ.在1×105Pa, 25℃时,H-H键、N ≡N键和N- H键的键能分别为436 kJ·mol-1、945 kJ·mol-1和391 kJ·mol-1。
(1)①根据上述数据判断工业合成氨的反应是___________ (填“吸热”或“放热”)反应:
②25℃时,在催化剂存在下进行反应,消耗1 mol氮气和3 mol氢气,理论上放出或吸收的热量为Q1,实际生产中,加入0.5 mol氮气和1.5 mol氢气放出或吸收的热量为Q2, Q1与Q2比较,正确的是___________ 。
a. Q1> 2Q2 b. Q1<2Q2 C. Q1=2Q2 d.2Q1<Q2
Ⅱ. 某可逆反应在体积为5L的密闭容器中进行,0~3 min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
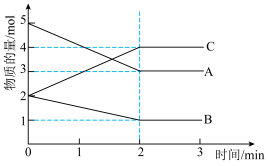
(2)该反应的化学方程式为___________ 。
(3)反应开始至2min时,B的平均反应速率为___________ 。
(4)能说明该反应已达到平衡状态的是___________ (填字母)。
a. v(A)=2v(B)
b.容器内混合气体的密度保持不变
c.2v正(A)=v逆(B)
d.容器内各物质浓度保持不变
(5)在密闭容器里,通入一定量的A、B、C,发生上述反应。达平衡后,当改变下列条件时,反应速率会减小的是___________ (填序号)。
①降低温度 ②加入正催化剂 ③减小容器容积
Ⅲ.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:
(6)乙装置中负极反应式为___________ 。
(7)丙装置中溶液碱性___________ (填“增强”或“减弱”)。
(8)假设开始时甲装置中两电极质量相等,导线中转移0.3 mol电子时,两电极质量相差___________ g。
(1)①根据上述数据判断工业合成氨的反应是
②25℃时,在催化剂存在下进行反应,消耗1 mol氮气和3 mol氢气,理论上放出或吸收的热量为Q1,实际生产中,加入0.5 mol氮气和1.5 mol氢气放出或吸收的热量为Q2, Q1与Q2比较,正确的是
a. Q1> 2Q2 b. Q1<2Q2 C. Q1=2Q2 d.2Q1<Q2
Ⅱ. 某可逆反应在体积为5L的密闭容器中进行,0~3 min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。

(2)该反应的化学方程式为
(3)反应开始至2min时,B的平均反应速率为
(4)能说明该反应已达到平衡状态的是
a. v(A)=2v(B)
b.容器内混合气体的密度保持不变
c.2v正(A)=v逆(B)
d.容器内各物质浓度保持不变
(5)在密闭容器里,通入一定量的A、B、C,发生上述反应。达平衡后,当改变下列条件时,反应速率会减小的是
①降低温度 ②加入正催化剂 ③减小容器容积
Ⅲ.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:

(6)乙装置中负极反应式为
(7)丙装置中溶液碱性
(8)假设开始时甲装置中两电极质量相等,导线中转移0.3 mol电子时,两电极质量相差
您最近半年使用:0次
名校
4 . 锂离子电池是目前手机、笔记本电脑等现代数码产品中应用最广泛的电池,它主要依靠锂离子在正极和负极之间移动来工作。典型的锰酸锂可充电电池的总反应为:LixC6 + Li1−xMn2O4 C6 + LiMn2O4。其电极分别为层状LiMn2O4和碳材料。下列说法正确的是
C6 + LiMn2O4。其电极分别为层状LiMn2O4和碳材料。下列说法正确的是
 C6 + LiMn2O4。其电极分别为层状LiMn2O4和碳材料。下列说法正确的是
C6 + LiMn2O4。其电极分别为层状LiMn2O4和碳材料。下列说法正确的是| A.放电时层状LiMn2O4电极作正极 |
| B.充电时碳材料应接电源的正极 |
| C.充电时阳极反应为:C6 + xLi+ - xe− = LixC6 |
| D.放电时,Li+嵌入碳材料使该电极增重 |
您最近半年使用:0次
2023-05-03更新
|
369次组卷
|
5卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一下学期第三次质量监测化学试题
名校
5 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
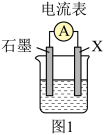
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为_____ (填化学式),石墨电极的电极反应式为_____ 。将石墨换成铁电极后,电池总反应变为_____ 。
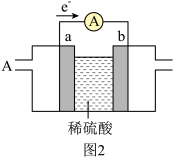
(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为_____ 极,正极的电极反应式为_____ 。当通入4.48L(标准状况下)甲烷气体时,测得电路中转移1.1mol电子,则甲烷的利用率为_____ 。(保留小数点后1位)。
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为_____ 。当H2和CO共生成2mol时,生成标准状况下O2的体积为_____ 。
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为

(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为

(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为
您最近半年使用:0次
2023-04-29更新
|
233次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
解题方法
6 . 燃料电池是一种将燃料的化学能直接转化为电能的电化学反应装置,甲醇一氧气燃料电池示意图如图,下列说法正确的是
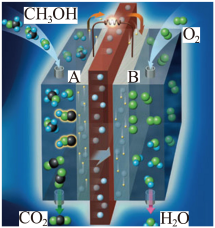

| A.电极A处发生还原反应 |
| B.放电时,电子由电极A→外电路→电极B→内电路→电极A形成闭合电路 |
C.放电时,负极的电极反应式为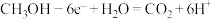 |
D.放电时,电路中每转移0.4 mol  ,消耗 ,消耗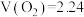 L L |
您最近半年使用:0次
2023-04-28更新
|
143次组卷
|
2卷引用:河北省邯郸市九县区2022-2023学年高一下学期4月期中联考化学试题
解题方法
7 . 电化学原理广泛应用于日常生活、生产和科学技术等方面,以满足不同的需要。根据如图所示实验装置,分别回答下列问题:
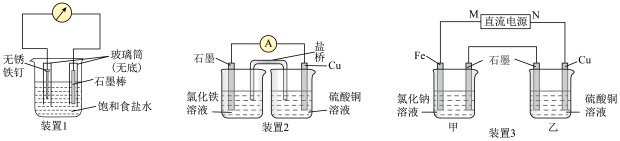
(1)装置1中石墨棒电极的电极反应式为_______ 。
(2)装置2中的 是
是_______ (填“正”或“负”)极,该装置发生的总反应的离子方程式为_______ 。
(3)装置3中甲烧杯盛放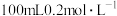 的
的 溶液,乙烧杯盛放
溶液,乙烧杯盛放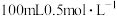 的
的 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①甲烧杯中铁电极的电极反应为_______ 。
②乙烧杯中电解反应的离子方程式为_______ 。
③停止电解,取出 电极,洗涤、干燥、称量,电极增重
电极,洗涤、干燥、称量,电极增重 ,则甲烧杯中产生的气体在标准状况下的体积为
,则甲烧杯中产生的气体在标准状况下的体积为_______  。
。
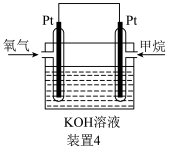
(4)装置4为甲烷燃料电池的构造示意图。负极的电极反应式为_______ 。

(1)装置1中石墨棒电极的电极反应式为
(2)装置2中的
 是
是(3)装置3中甲烧杯盛放
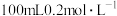 的
的 溶液,乙烧杯盛放
溶液,乙烧杯盛放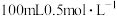 的
的 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。①甲烧杯中铁电极的电极反应为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出
 电极,洗涤、干燥、称量,电极增重
电极,洗涤、干燥、称量,电极增重 ,则甲烧杯中产生的气体在标准状况下的体积为
,则甲烧杯中产生的气体在标准状况下的体积为 。
。(4)装置4为甲烷燃料电池的构造示意图。负极的电极反应式为

您最近半年使用:0次
解题方法
8 . 研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池。该电池分别以铝和石墨为电极,用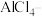 和有机阳离子构成的电解质溶液作为离子导体,其放电原理如图所示。下列说法中,正确的是
和有机阳离子构成的电解质溶液作为离子导体,其放电原理如图所示。下列说法中,正确的是
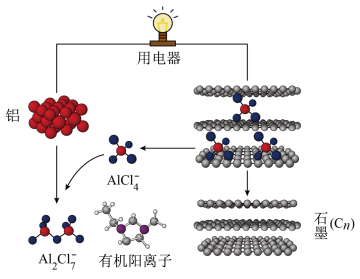
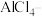 和有机阳离子构成的电解质溶液作为离子导体,其放电原理如图所示。下列说法中,正确的是
和有机阳离子构成的电解质溶液作为离子导体,其放电原理如图所示。下列说法中,正确的是
| A.放电时,有机阳离子向铝电极方向移动 |
| B.充电时,铝要与电源正极相连 |
C.放电时的正极反应为: |
D.充电时的阴极反应为: |
您最近半年使用:0次
解题方法
9 . 化学电池是新能源和可再生能源的重要组成部分。根据所学知识,回答下列问题:
(1)甲、乙两位同学想探究铝电极在原电池中的作用,两人均用镁片和铝片作电极,但甲同学将电极放入稀硫酸中,乙同学将电极放入 溶液中,实验装置如图所示。
溶液中,实验装置如图所示。
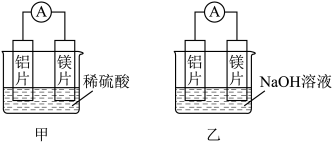
①写出甲中电池总反应的离子方程式:_________ 。
②乙中铝为_________ 极,写出铝电极的电极反应式:_________ 。
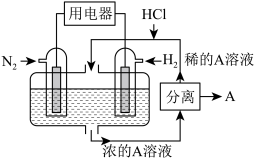
(2)有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是_________ ,A是_________ (填化学式)。
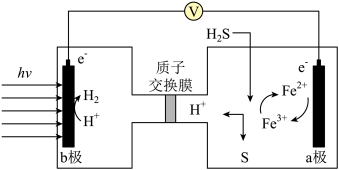
(3)我国科学家在太阳能光电催化一化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。b极为光能转化为电能的装置,该电极的电极材料可用_________ (填化学式),该装置的总反应为__________________ ,a极发生的反应为_________ (填“氧化”或“还原”)反应。
(1)甲、乙两位同学想探究铝电极在原电池中的作用,两人均用镁片和铝片作电极,但甲同学将电极放入稀硫酸中,乙同学将电极放入
 溶液中,实验装置如图所示。
溶液中,实验装置如图所示。
①写出甲中电池总反应的离子方程式:
②乙中铝为
(2)有人设想以
 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是
(3)我国科学家在太阳能光电催化一化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。b极为光能转化为电能的装置,该电极的电极材料可用

您最近半年使用:0次
2023-04-27更新
|
178次组卷
|
2卷引用:河北省邢台市2022-2023学年高一下学期期中考试化学试题
名校
10 . 锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。电池反应式为:Li1-xMnO4+xLi LiMnO4,下列有关说法不正确的是
LiMnO4,下列有关说法不正确的是
 LiMnO4,下列有关说法不正确的是
LiMnO4,下列有关说法不正确的是| A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-=LiMnO4 |
| B.放电过程中,内电路电流方向是从负极到正极 |
| C.该电池也能在KOH溶液的环境中正常工作 |
| D.放电时Li+向电池正极方向定向迁移 |
您最近半年使用:0次
2023-04-27更新
|
424次组卷
|
2卷引用:湖北省武汉外国语学校2022-2023学年高一下学期期中考试化学试题



