名校
解题方法
1 .  空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
 空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
| A.a膜为阴离子交换膜 |
B.乙池中阴极的电极反应式为 |
C.当浓缩室得到 的盐酸时,M室溶液的质量变化为 的盐酸时,M室溶液的质量变化为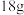 (溶液体积变化忽略不计) (溶液体积变化忽略不计) |
D.标况下,若甲池有 参加反应,则乙池中处理废气( 参加反应,则乙池中处理废气( 和 和 )的总体积为 )的总体积为 |
您最近一年使用:0次
2024-01-06更新
|
785次组卷
|
5卷引用:湖南省长沙市雅礼中学2023-2024学年高二下学期第一次月考化学试卷
湖南省长沙市雅礼中学2023-2024学年高二下学期第一次月考化学试卷贵州省贵阳市第一中学2023-2024学年高三上学期11月高考适应性月考化学试卷(三)(已下线)题型11 新型电化学装置分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
2 . 液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其放电过程示意图如图。下列说法不正确 的是
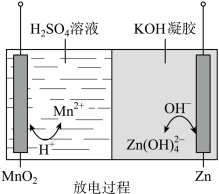
已知:① ;②KOH凝胶中允许离子存在、生成或迁移。
;②KOH凝胶中允许离子存在、生成或迁移。

已知:①
 ;②KOH凝胶中允许离子存在、生成或迁移。
;②KOH凝胶中允许离子存在、生成或迁移。A.充电过程中,阴极的电极反应: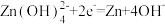 |
B.放电过程中,正极的电极反应: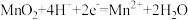 |
C.放电过程中, 由正极向负极迁移 由正极向负极迁移 |
D.在充、放电过程中,凝胶中的 可再生 可再生 |
您最近一年使用:0次
2024-01-04更新
|
511次组卷
|
7卷引用:湖南省长沙市明德中学 2021-2022学年高二上学期12月月考化学试题
名校
3 . 神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用∆HfHm表示。如N2H4(1)的摩尔生成焓:N2(g)+2H2(g)=N2H4(l) ∆HfHm =+165.8kJ/mol
①∆H1=___________ kJ/mol。
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是___________ 。
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。___________ ,反应a的标准压强平衡常数表达式 =
=___________ 。
②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为___________ ,H2的平衡分压为___________ (结果保留3位有效数字)kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
| 物质 | N2O4(g) | N2H4(l) | H2O(g) |
| 摩尔生成焓∆HfHm(kJ/mol) | +10.8 | +165.8. | -242.0 |
①∆H1=
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
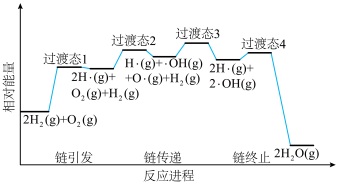
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随
 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。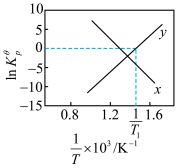
 =
=②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:
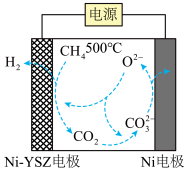
您最近一年使用:0次
2024-01-03更新
|
427次组卷
|
3卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
名校
解题方法
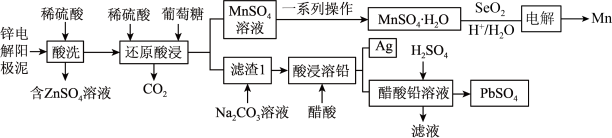
4 . 一种回收锌电解阳极泥(主要成分为 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
已知:① 易溶于水,不溶于乙醇;
易溶于水,不溶于乙醇;
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

(1)基态Mn原子核外电子的空间运动状态有___________ 种。
(2)“还原酸浸”过程中二氧化锰参与反应的化学方程式为___________ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是___________ 、___________ ,用___________ (填物质的名称)洗涤、干燥。

(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是___________ 。
(5)“电解”时,加入 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积,则
电还原沉积,则 放电的电极反应式为
放电的电极反应式为___________ 。
(6)关于流程中有关物质的说法正确的是___________(填标号)。
 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
已知:①
 易溶于水,不溶于乙醇;
易溶于水,不溶于乙醇;②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

(1)基态Mn原子核外电子的空间运动状态有
(2)“还原酸浸”过程中二氧化锰参与反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(5)“电解”时,加入
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积,则
电还原沉积,则 放电的电极反应式为
放电的电极反应式为(6)关于流程中有关物质的说法正确的是___________(填标号)。
| A.葡萄糖溶于水,葡萄糖分子能与水分子形成氢键 |
B.Ag和Cu是同族元素且相邻,基态Ag原子的价电子轨道表示式为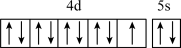 |
C. 与 与 均属于分子晶体, 均属于分子晶体, 为非极性分子,其空间结构为直线形 为非极性分子,其空间结构为直线形 |
| D.流程中的“滤液2”可循环利用 |
您最近一年使用:0次
名校
解题方法
5 . 化学在日常生活、工农业生产中的应用非常广泛,下列化学原理或应用的方程式书写正确的是
A. (燃烧热是890.3kJ/mol)是重要的燃料,表示 (燃烧热是890.3kJ/mol)是重要的燃料,表示 的燃烧热的热化学方程式为 的燃烧热的热化学方程式为  |
B.钢铁浸泡在NaCl溶液中被腐蚀的正极反应: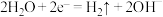 |
C.向硫酸铜溶液中加入过量的NaHS溶液除 : : |
D.用石墨电极电解 溶液: 溶液: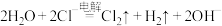 |
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
|
6 . 镓是制作高性能半导体的重要原料,常从锌矿冶炼的废渣中回收镓。一种利用湿法提锌后的浸出渣(主要含一定量 和
和 、
、 、
、 、
、 的化合物)为原料制备高纯镓的流程如图所示:
的化合物)为原料制备高纯镓的流程如图所示:
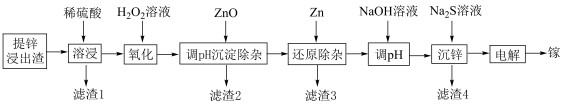
请回答下列问题:
(1)已知 的熔点为77.9℃,沸点为201.3℃,据此推断固态
的熔点为77.9℃,沸点为201.3℃,据此推断固态 的晶体类型为
的晶体类型为___________ 。
(2)写出能提高“溶浸”速率的一个措施___________ 。
(3)滤渣3的成分除过量的锌以外还含有___________ 。
(4)往 酸化的
酸化的 溶液中加入
溶液中加入 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(5)在0.1mol/L的 溶液中,下列说法正确的是
溶液中,下列说法正确的是___________ 。
a.
b.
c.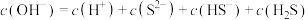
d.加水稀释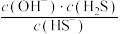 变大
变大
(6)滤渣4经 溶解后经一系列操作可获得
溶解后经一系列操作可获得 ,制得的
,制得的 在烘干时需减压烘干的原因是
在烘干时需减压烘干的原因是___________ 。
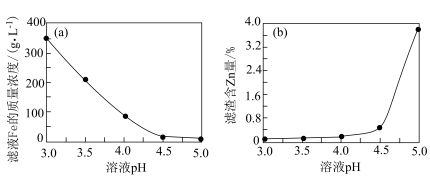
(7)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为___________ 。
(8)已知:Ga在碱性溶液中以 形式存在,写出电解制镓时的阴极电极反应式
形式存在,写出电解制镓时的阴极电极反应式___________ 。
 和
和 、
、 、
、 、
、 的化合物)为原料制备高纯镓的流程如图所示:
的化合物)为原料制备高纯镓的流程如图所示:
请回答下列问题:
(1)已知
 的熔点为77.9℃,沸点为201.3℃,据此推断固态
的熔点为77.9℃,沸点为201.3℃,据此推断固态 的晶体类型为
的晶体类型为(2)写出能提高“溶浸”速率的一个措施
(3)滤渣3的成分除过量的锌以外还含有
(4)往
 酸化的
酸化的 溶液中加入
溶液中加入 发生反应的化学方程式为
发生反应的化学方程式为(5)在0.1mol/L的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是a.

b.

c.
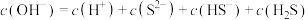
d.加水稀释
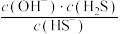 变大
变大(6)滤渣4经
 溶解后经一系列操作可获得
溶解后经一系列操作可获得 ,制得的
,制得的 在烘干时需减压烘干的原因是
在烘干时需减压烘干的原因是(7)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为

(8)已知:Ga在碱性溶液中以
 形式存在,写出电解制镓时的阴极电极反应式
形式存在,写出电解制镓时的阴极电极反应式
您最近一年使用:0次
7 . 有机物电化学合成是化学研究的重要方向。下图所示电解装置可以生成葡萄糖酸(C6H12O7)和山梨醇(C6H14O6)。葡萄糖酸是制备补钙剂的重要原料,山梨醇也是一种常见的食品添加剂。

下列说法错误的是

下列说法错误的是
| A.葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 |
| B.在“电解质溶液1”中,1mol葡萄糖被HBrO还原成葡萄糖酸转移2mol电子 |
| C.H+通过阳离子交换膜向电极N移动 |
| D.阴极反应为C6Hl2O6+2H++2e-=C6H14O6 |
您最近一年使用:0次
2023-12-31更新
|
380次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期月考(5)化学试卷
名校
解题方法
8 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是

 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
A.a极每 参与反应,有 参与反应,有 移向氯化钠溶液 移向氯化钠溶液 |
| B.相同条件下,电极b与c产生气体的体积比为7:3 |
| C.电极c为阴极,发生还原反应 |
D.d极区苯酚被氧化的化学方程式为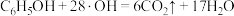 |
您最近一年使用:0次
名校
9 . 当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:
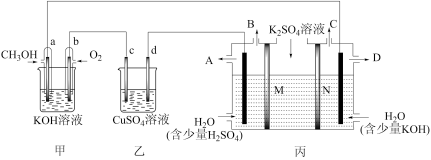
(1)甲装置是_____ (填“原电池”或“电解池”),写出a极的电极反应_____ 。
(2)乙池中c极的电极反应_____ 。
(3)当b极消耗标准状况下的 112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=
112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=_____ 。
(4)用石墨电极电解 溶液一段时间后,向所得溶液中加入0.2mol
溶液一段时间后,向所得溶液中加入0.2mol 后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量是_____。
后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量是_____。
(5)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为_____ (写化学式),M为_____ 离子交换膜(填“阴”或“阳”)。

(1)甲装置是
(2)乙池中c极的电极反应
(3)当b极消耗标准状况下的
 112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=
112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=(4)用石墨电极电解
 溶液一段时间后,向所得溶液中加入0.2mol
溶液一段时间后,向所得溶液中加入0.2mol 后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量是_____。
后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量是_____。| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |
(5)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为
您最近一年使用:0次
名校
解题方法
10 . 研究表明,以辛胺[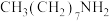 ]和
]和 为原料高选择性地合成辛腈[
为原料高选择性地合成辛腈[ ]和甲酸盐的工作原理如图,下列说法不正确的是
]和甲酸盐的工作原理如图,下列说法不正确的是
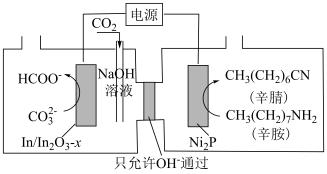
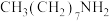 ]和
]和 为原料高选择性地合成辛腈[
为原料高选择性地合成辛腈[ ]和甲酸盐的工作原理如图,下列说法不正确的是
]和甲酸盐的工作原理如图,下列说法不正确的是
A.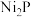 电极与电源正极相连 电极与电源正极相连 |
B.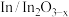 电极上可能有副产物 电极上可能有副产物 生成 生成 |
C.在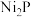 电极上发生的反应为: 电极上发生的反应为: |
D.电路中转移 电子时,阴极区溶液质量增加 电子时,阴极区溶液质量增加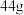 (不考虑气体的溶解) (不考虑气体的溶解) |
您最近一年使用:0次
2023-12-14更新
|
186次组卷
|
2卷引用:湖南省永州市第一中学2023-2024学年高二上学期12月月考化学试题



