1 . 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4 +10H2O ⇌4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有
+10H2O ⇌4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有___ 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=_______ 的溶液。
(2)高铁酸钾有以下几种常见制备方法:

①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为___________ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:___________________________________ 。
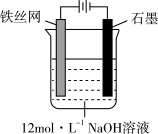
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为_______________ 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)(OH)2+2Fe(OH)3+4KOH 放电时负极附近pH变化
3Zn(OH)(OH)2+2Fe(OH)3+4KOH 放电时负极附近pH变化_______________ ,正极反应为:____________________ 。
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的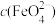 有沉淀产生,理论上至少加入Ca(OH)2的物质的量为
有沉淀产生,理论上至少加入Ca(OH)2的物质的量为________ mol。
(1)已知:4
 +10H2O ⇌4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有
+10H2O ⇌4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=
(2)高铁酸钾有以下几种常见制备方法:

①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为

(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)(OH)2+2Fe(OH)3+4KOH 放电时负极附近pH变化
3Zn(OH)(OH)2+2Fe(OH)3+4KOH 放电时负极附近pH变化(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的
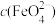 有沉淀产生,理论上至少加入Ca(OH)2的物质的量为
有沉淀产生,理论上至少加入Ca(OH)2的物质的量为
您最近一年使用:0次
2 . 化学平衡原理是中学化学学习的重要内容.请回答下列问题:
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是.②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示.电池正极的电极反应式是,A是.

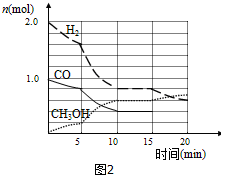
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇.反应为CO(g)+2H2(g) CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见右图:
CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见右图:
①从反应开始至平衡时,用CO表示化学反应速率为,该温度下的平衡常数为.
②5min至10min时速率变化的原因可能是;
③15min时对反应体系采取了一个措施,至20min时CO的物质的量为0.5mol,请在图中画出CO的变化曲线.
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化).如果溶液pH=7,此时V的取值20.00(填“>”、“=”或“<”),溶液中c(Na+)、c(CH3COO﹣)、c(H+)、c(OH﹣)的大小关系是.
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为(用含有a、b字母的代数式表示).
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是.②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示.电池正极的电极反应式是,A是.


(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇.反应为CO(g)+2H2(g)
 CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见右图:
CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见右图:①从反应开始至平衡时,用CO表示化学反应速率为,该温度下的平衡常数为.
②5min至10min时速率变化的原因可能是;
③15min时对反应体系采取了一个措施,至20min时CO的物质的量为0.5mol,请在图中画出CO的变化曲线.
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化).如果溶液pH=7,此时V的取值20.00(填“>”、“=”或“<”),溶液中c(Na+)、c(CH3COO﹣)、c(H+)、c(OH﹣)的大小关系是.
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为(用含有a、b字母的代数式表示).
您最近一年使用:0次
2016-12-09更新
|
395次组卷
|
3卷引用:2016届湖南省衡阳八中高三第一次模拟理综化学试卷
名校
3 . 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是


| A.a电极反应式是4OH- -4e-==O2↑+2H2O |
| B.b电极是阴极 |
| C.电解过程中水是氧化剂 |
| D.b电极附近溶液的pH变大 |
您最近一年使用:0次
2016-12-09更新
|
148次组卷
|
2卷引用:湖南省常德市石门县第一中学2021-2022学年高一下学期期中考试化学试题
名校
4 . 下图是化学能与电能相互转化的两套装置。下列分析正确的是


| A.两装置中,铁电极均要消耗 |
| B.图2装置中两极均有气泡产生 |
| C.图1装置铁电极上发生的电极反应为:Fe-3e-===Fe3+ |
| D.随着反应的进行,图1装置中溶液的pH增大,图2装置中溶液的pH不变 |
您最近一年使用:0次
2016-12-09更新
|
93次组卷
|
2卷引用:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷
5 . 用惰性电极电解2L0.5mol/L的硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是
| A.1 | B.2 | C.3 | D.无法确定 |
您最近一年使用:0次
2014·广东汕头·二模
名校
6 . 减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为______________ 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是____ (填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。

①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=_____ 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为_______ 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为_______________ 。
②电化学降解NO3-的原理如图所示,电源正极为____ (填“a”或“b”);若总反应为4NO3-+4H+ 5O2↑+2N2↑+2H2O,则阴极反应式为
5O2↑+2N2↑+2H2O,则阴极反应式为__________________ 。

(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+
 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1C(s)+
 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1则焦炭与水蒸气反应生成CO的热化学方程式为
②洗涤含SO2的烟气。以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。

①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为
②电化学降解NO3-的原理如图所示,电源正极为
 5O2↑+2N2↑+2H2O,则阴极反应式为
5O2↑+2N2↑+2H2O,则阴极反应式为
您最近一年使用:0次
2016-12-09更新
|
810次组卷
|
4卷引用:湖南省长沙市第一中学2020届高三第五次月考化学试题
湖南省长沙市第一中学2020届高三第五次月考化学试题(已下线)2013-2014广东省汕头市高三4月第二次模拟理综化学试卷(已下线)2013-2014广东肇庆市高中毕业班第二次模拟考试理综化学试卷2015届北京市清华大学附属中学高三4月综合测(四)化学试卷
名校
解题方法
7 . 液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是
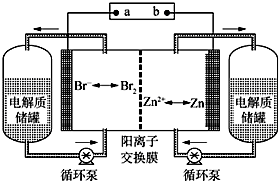

| A.充电时阳极的电极反应式:Zn-2e-=Zn2+ |
| B.充电时电极a为外接电源的负极 |
| C.放电时Br-向右侧电极移动 |
| D.放电时左右两侧电解质储罐中的离子总浓度均增大 |
您最近一年使用:0次
2016-12-09更新
|
469次组卷
|
7卷引用:2015届湖南省张家界市高三4月模拟练习卷理科综合化学试卷
解题方法
8 . 如图是CO2电催化还原为CH4的工作原理示意图。正确的是
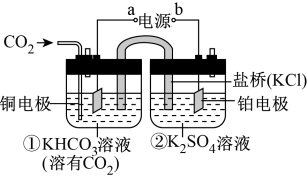

| A.该装置为原电池,其中a为正极 |
| B.铜电极的电极反应式为:CO2+8H++8e-=CH4+2H2O |
| C.反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 |
| D.一段时间后,②池中溶液的pH不变 |
您最近一年使用:0次
2016-12-09更新
|
346次组卷
|
2卷引用:2015届湖南省怀化市高三下学期第三次质量监测理综化学试卷
9 . SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成 的离子方程为
的离子方程为_____ 。
(2)含硫各微粒(H2SO3、 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①下列说法正确的是________ (填字母序号)。
a.pH=8时,溶液中c( ) < c(
) < c( )
)
b.pH=7时,溶液中c(Na+) =c( )+c(
)+c( )
)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_____ 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是 、
、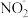 ,写出生成NO3-的离子方程式
,写出生成NO3-的离子方程式_______ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为______ 。
②生成Ce4+从电解槽的________ (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2_________ L(用含a代数式表示,计算结果保留整数)。

(1)装置Ⅰ中生成
 的离子方程为
的离子方程为(2)含硫各微粒(H2SO3、
 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
①下列说法正确的是
a.pH=8时,溶液中c(
 ) < c(
) < c( )
)b.pH=7时,溶液中c(Na+) =c(
 )+c(
)+c( )
)c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是
 、
、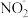 ,写出生成NO3-的离子方程式
,写出生成NO3-的离子方程式(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为
②生成Ce4+从电解槽的
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2
您最近一年使用:0次
2016-12-09更新
|
862次组卷
|
2卷引用:2015届湖南省长沙市雅礼中学高三5月一模化学试卷
10 . 某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。

①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、___________________________ 。
阳极的电极反应式为___________________________________ 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
_______________________________________________________________________________ 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式:_________________________________ 。该步骤一般在80℃以下进行,温度不能太高的原因是________________________________ 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是____________________ (填字母序号)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于_________________ g。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。

①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、
阳极的电极反应式为
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式:
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于
您最近一年使用:0次
2016-12-09更新
|
786次组卷
|
3卷引用:2016-2017学年湖南省衡阳八中高二上月考四化学卷



