镓是制作高性能半导体的重要原料,常从锌矿冶炼的废渣中回收镓。一种利用湿法提锌后的浸出渣(主要含一定量 和
和 、
、 、
、 、
、 的化合物)为原料制备高纯镓的流程如图所示:
的化合物)为原料制备高纯镓的流程如图所示:
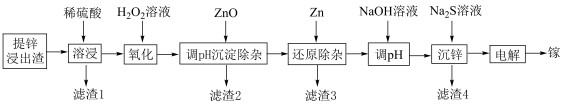
请回答下列问题:
(1)已知 的熔点为77.9℃,沸点为201.3℃,据此推断固态
的熔点为77.9℃,沸点为201.3℃,据此推断固态 的晶体类型为
的晶体类型为___________ 。
(2)写出能提高“溶浸”速率的一个措施___________ 。
(3)滤渣3的成分除过量的锌以外还含有___________ 。
(4)往 酸化的
酸化的 溶液中加入
溶液中加入 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(5)在0.1mol/L的 溶液中,下列说法正确的是
溶液中,下列说法正确的是___________ 。
a.
b.
c.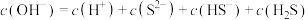
d.加水稀释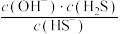 变大
变大
(6)滤渣4经 溶解后经一系列操作可获得
溶解后经一系列操作可获得 ,制得的
,制得的 在烘干时需减压烘干的原因是
在烘干时需减压烘干的原因是___________ 。
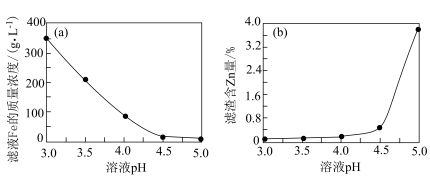
(7)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为___________ 。
(8)已知:Ga在碱性溶液中以 形式存在,写出电解制镓时的阴极电极反应式
形式存在,写出电解制镓时的阴极电极反应式___________ 。
 和
和 、
、 、
、 、
、 的化合物)为原料制备高纯镓的流程如图所示:
的化合物)为原料制备高纯镓的流程如图所示:
请回答下列问题:
(1)已知
 的熔点为77.9℃,沸点为201.3℃,据此推断固态
的熔点为77.9℃,沸点为201.3℃,据此推断固态 的晶体类型为
的晶体类型为(2)写出能提高“溶浸”速率的一个措施
(3)滤渣3的成分除过量的锌以外还含有
(4)往
 酸化的
酸化的 溶液中加入
溶液中加入 发生反应的化学方程式为
发生反应的化学方程式为(5)在0.1mol/L的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是a.

b.

c.
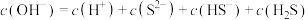
d.加水稀释
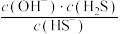 变大
变大(6)滤渣4经
 溶解后经一系列操作可获得
溶解后经一系列操作可获得 ,制得的
,制得的 在烘干时需减压烘干的原因是
在烘干时需减压烘干的原因是(7)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为

(8)已知:Ga在碱性溶液中以
 形式存在,写出电解制镓时的阴极电极反应式
形式存在,写出电解制镓时的阴极电极反应式
更新时间:2024-01-01 19:58:07
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)写出H2CO3的第一级电离平衡常数表达式:Ka1=_______ 。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3溶液的pH由大到小的顺序为_______ (填字母)。
(3)常温下,0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______(填字母)。
(4)一定温度下,体积均为100mL、pH=2的CH3COOH溶液与一元酸HX的溶液,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_______ (填“大于”“小于”或“等于”,下同)CH3COOH的电离平衡常数。

(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_______ mol·L-1(填精确值)。
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数/(mol·L-1) | 1.7×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)写出H2CO3的第一级电离平衡常数表达式:Ka1=
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3溶液的pH由大到小的顺序为
(3)常温下,0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______(填字母)。
| A.c(H+) | B. | C.c(H+)c(OH-) | D. |

(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】碳达峰、碳中和是近年来世界各国研究的重要课题,合理利用 ,对减少
,对减少 的排放及解决能源短缺问题具有重大意义。回答下列问题:
的排放及解决能源短缺问题具有重大意义。回答下列问题:
(1)利用 催化氢化制甲烷的反应为
催化氢化制甲烷的反应为
 。已知部分化学键的键能数据如表所示:
。已知部分化学键的键能数据如表所示:
则该反应的反应热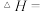
_______ 。
(2)Fujta等学者开展了在 催化剂上进行
催化剂上进行 和
和 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下:
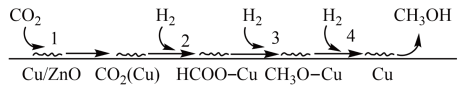
①过程2的化学方程式为_______ 。
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是_______ (填标号)。
A.温度变化导致活化能增大 B.温度变化导致平衡常数减小
C. 对该反应有阻碍作用 D.
对该反应有阻碍作用 D. 的存在削弱了同一吸附位上
的存在削弱了同一吸附位上 的吸附
的吸附
(3)一定温度下, 和
和 制备甲醇的主要反应为:
制备甲醇的主要反应为: ,在容积恒定的密闭容器中充入
,在容积恒定的密闭容器中充入 和
和 ,达到平衡时测得容器内的压强为
,达到平衡时测得容器内的压强为 ,
, 的物质的量为
的物质的量为 。在此条件下,
。在此条件下, 的转化率
的转化率
_______ ,该反应的平衡常数
_______ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)一种捕集烟气中 的过程如图所示。室温下以
的过程如图所示。室温下以 溶液吸收
溶液吸收 ,若通入
,若通入 所引起的溶液体积变化和
所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度
挥发可忽略,溶液中含碳物种的浓度 。
。 电离常数分别为
电离常数分别为 、
、 。完成下列问题:
。完成下列问题:
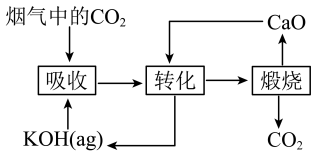
①如图所示的“吸收”“转化”过程中,溶液的温度_______ (填“下降”、“不变”或“上升”)。
②KOH完全转化为 时,溶液中:
时,溶液中:
_______ 。
③KOH溶液吸收 ,
, 溶液中:
溶液中: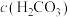
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
 ,对减少
,对减少 的排放及解决能源短缺问题具有重大意义。回答下列问题:
的排放及解决能源短缺问题具有重大意义。回答下列问题:(1)利用
 催化氢化制甲烷的反应为
催化氢化制甲烷的反应为
 。已知部分化学键的键能数据如表所示:
。已知部分化学键的键能数据如表所示:| 化学键 |  |  |  |  |
键能 | 414 | 436 | 745 | 463 |
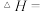
(2)Fujta等学者开展了在
 催化剂上进行
催化剂上进行 和
和 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下:
①过程2的化学方程式为
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是
A.温度变化导致活化能增大 B.温度变化导致平衡常数减小
C.
 对该反应有阻碍作用 D.
对该反应有阻碍作用 D. 的存在削弱了同一吸附位上
的存在削弱了同一吸附位上 的吸附
的吸附(3)一定温度下,
 和
和 制备甲醇的主要反应为:
制备甲醇的主要反应为: ,在容积恒定的密闭容器中充入
,在容积恒定的密闭容器中充入 和
和 ,达到平衡时测得容器内的压强为
,达到平衡时测得容器内的压强为 ,
, 的物质的量为
的物质的量为 。在此条件下,
。在此条件下, 的转化率
的转化率

 总压
总压 物质的量分数)。
物质的量分数)。(4)一种捕集烟气中
 的过程如图所示。室温下以
的过程如图所示。室温下以 溶液吸收
溶液吸收 ,若通入
,若通入 所引起的溶液体积变化和
所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度
挥发可忽略,溶液中含碳物种的浓度 。
。 电离常数分别为
电离常数分别为 、
、 。完成下列问题:
。完成下列问题:
①如图所示的“吸收”“转化”过程中,溶液的温度
②KOH完全转化为
 时,溶液中:
时,溶液中:
③KOH溶液吸收
 ,
, 溶液中:
溶液中: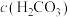
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】室温下,用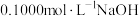 滴定
滴定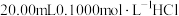 溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。
溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。

(1)酸碱式滴定管在加溶液滴定前,需要的操作是___________ 和___________ 。
(2)配制上述NaOH标准溶液时,下列仪器中不必要 用到的有___________ 。(用编号表示)
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(3)当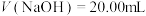 时,溶液中所有离子的浓度存在的关系是
时,溶液中所有离子的浓度存在的关系是___________ 。
(4)已知 ,当加入的
,当加入的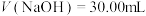 时,溶液中pH=
时,溶液中pH=___________ 。
(5)下列说法不正确 的是___________ 。
A.NaOH与盐酸恰好完全反应时,
B.选择甲基红指示反应终点,误差比甲基橙的大
C.当接近滴定终点时,极少量的碱就会引起溶液的pH突变
D.选择变色范围在pH突变范围内的指示剂,可减小实验误差
E.当用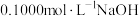 滴定
滴定 溶液时,其突变范围比滴定
溶液时,其突变范围比滴定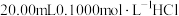 溶液的突变范围大
溶液的突变范围大
(6)在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 和
和 反应生成砖红色沉淀表示滴定终点。当溶液中的
反应生成砖红色沉淀表示滴定终点。当溶液中的 恰好完全沉淀时,溶液中的
恰好完全沉淀时,溶液中的
___________  ;
;
___________  。
。
已知:①25℃时, ,
,
②当溶液中某种离子的浓度等于或小于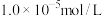 时,可认为已完全沉淀。
时,可认为已完全沉淀。
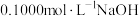 滴定
滴定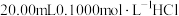 溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。
溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。
(1)酸碱式滴定管在加溶液滴定前,需要的操作是
(2)配制上述NaOH标准溶液时,下列仪器中
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(3)当
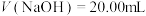 时,溶液中所有离子的浓度存在的关系是
时,溶液中所有离子的浓度存在的关系是(4)已知
 ,当加入的
,当加入的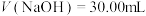 时,溶液中pH=
时,溶液中pH=(5)下列说法
A.NaOH与盐酸恰好完全反应时,

B.选择甲基红指示反应终点,误差比甲基橙的大
C.当接近滴定终点时,极少量的碱就会引起溶液的pH突变
D.选择变色范围在pH突变范围内的指示剂,可减小实验误差
E.当用
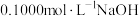 滴定
滴定 溶液时,其突变范围比滴定
溶液时,其突变范围比滴定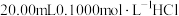 溶液的突变范围大
溶液的突变范围大(6)在化学分析中,以
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 和
和 反应生成砖红色沉淀表示滴定终点。当溶液中的
反应生成砖红色沉淀表示滴定终点。当溶液中的 恰好完全沉淀时,溶液中的
恰好完全沉淀时,溶液中的
 ;
;
 。
。已知:①25℃时,
 ,
,
②当溶液中某种离子的浓度等于或小于
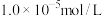 时,可认为已完全沉淀。
时,可认为已完全沉淀。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
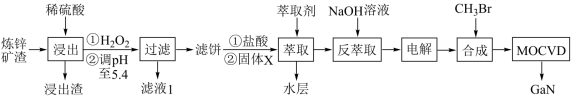
【推荐1】金属镓有“电子工业脊梁”的美誉,广泛应用于电子、航空航天、光学等领域。综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
②MOCVD是一种金属有机物化学气相淀积技术。
③常温下,浸出液中各离子形成氢氧化物沉淀的pH见下表。
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见下表。
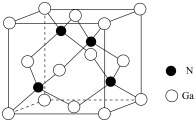
(1)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,GaN属于___________ 晶体;GaN晶体的一种立方晶胞如图所示,Ga的配位数为___________ 。___________ 。
(3)萃取前加入固体X的目的是___________ 。
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,纯镓为阴极,NaOH水溶液为电解质溶液。通电时,粗镓溶解以___________ (填离子符号)形式进入电解质溶液,并在阴极放电析出高纯镓,则阴极的电极反应方程式为___________ 。精炼时,若外电路通过0.25 mol e-时,阴极得到3.5 g的镓。则该电解装置的电解效率η=___________ (η=生成目标产物转移的电子数/转移的电子总数)。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN,该过程的化学方程式为___________ 。
②MOCVD是一种金属有机物化学气相淀积技术。
③常温下,浸出液中各离子形成氢氧化物沉淀的pH见下表。
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 金属离子 |  |  |  |  |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,GaN属于
(3)萃取前加入固体X的目的是
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,纯镓为阴极,NaOH水溶液为电解质溶液。通电时,粗镓溶解以
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN,该过程的化学方程式为
您最近一年使用:0次
【推荐2】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_______
(2)“电解Ⅰ”是电解熔融Al2O3,写出阳极的电极反应式_______ 。
(3)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_______ 。


注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为
(2)“电解Ⅰ”是电解熔融Al2O3,写出阳极的电极反应式
(3)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】羰基硫(COS)是一种粮食熏蒸剂,能防治某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: 。
。
(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。
①反应前 的物质的量为
的物质的量为_______ ,达到平衡时 的转化率为
的转化率为_______ (计算结果保留3位有效数字)。
②保持其他条件不变,向容器中通入更多CO气体,此时正反应速率_______ (填“增大”“减小”或“不变”)。
(2)在不同温度下达到化学平衡时, 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是_______ (填“吸热”或“放热”)反应。

(3)在某温度下,向1L的密闭容器中通入10molCO和 ,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为_______ 。
(4)因 有剧毒,含有
有剧毒,含有 的尾气需要经过处理再排放。一种处理方法是先用
的尾气需要经过处理再排放。一种处理方法是先用 溶液吸收含
溶液吸收含 的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。

①反应池中发生反应的离子方程式是_______ 。
②阳极的电极反应式为_______ 。
 混合加热并达到下列平衡:
混合加热并达到下列平衡: 。
。(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。
①反应前
 的物质的量为
的物质的量为 的转化率为
的转化率为②保持其他条件不变,向容器中通入更多CO气体,此时正反应速率
(2)在不同温度下达到化学平衡时,
 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是
(3)在某温度下,向1L的密闭容器中通入10molCO和
 ,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为(4)因
 有剧毒,含有
有剧毒,含有 的尾气需要经过处理再排放。一种处理方法是先用
的尾气需要经过处理再排放。一种处理方法是先用 溶液吸收含
溶液吸收含 的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
①反应池中发生反应的离子方程式是
②阳极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____ ,有____ 个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____ ,微粒之间存在的作用力是____ 。
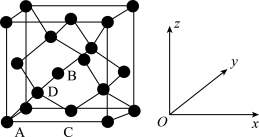
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____ 。
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】根据报道,贵州发现的超大型锰铜矿区资源量已超两亿吨。锰矿是国家紧缺战略矿产之一,在电池、磁性新材料等方面都有广泛应用。请回答下列问题:
(1)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①基态铜原子的价层电子排布式为___ 。
②CO和N2互为等电于体。N2分子中π键数目为__ 。
③HCHO分子的H—C—H键角__ (填“大于”“小于”或“等于”)CO2的键角,理由是___ 。
④向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO 的立体构型是
的立体构型是__ 。
(2)比较熔点:AlCl3__ AlF3(填“>”“<”或“=”),并解释其原因__ 。
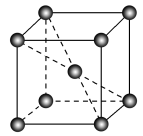
(3)锰晶胞如图所示,已知锰晶胞参数为apm。设锰晶胞中两个锰原子核之间最短距离为dpm,则d=__ ﹔锰晶胞中Mn的密度=__ g/cm3。
(1)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①基态铜原子的价层电子排布式为
②CO和N2互为等电于体。N2分子中π键数目为
③HCHO分子的H—C—H键角
④向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO
 的立体构型是
的立体构型是(2)比较熔点:AlCl3
(3)锰晶胞如图所示,已知锰晶胞参数为apm。设锰晶胞中两个锰原子核之间最短距离为dpm,则d=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式__________________ ;
②甲、乙元素的第一电离能关系为甲_______ 乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______ 晶体,其化学式为_____________ ,若使其熔化,需破坏的作用关系为_________ .
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。

①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子___________
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
①写出甲元素的电子排布式
②甲、乙元素的第一电离能关系为甲
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。

①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铂(Pt)是一种贵重金属,广泛用于化工领域。从某废催化剂(主要含有Pt、C、 、
、 )中回收Pt的一种工艺流程如图所示。回答下列问题:
)中回收Pt的一种工艺流程如图所示。回答下列问题:

(1)步骤Ⅰ焙烧的目的是___________ ,操作X的名称___________ 。
(2)实验人员采用三种不同的浸出试剂分别研究过程Ⅱ中Pt的浸出率。所用的浸出试剂分别是 、
、 和
和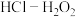 。
。
①将下列浸出反应的离子方程式补充完整:___________ 。




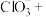
 ___________
___________


②当 或
或 作为氧化剂浸出等量Pt时,
作为氧化剂浸出等量Pt时,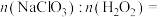
___________ 。
③ 相同、浸出时间相同时,三种浸出试剂对Pt的浸出率如下表所示:
相同、浸出时间相同时,三种浸出试剂对Pt的浸出率如下表所示:
注: 按照②中的物质的量关系换算成
按照②中的物质的量关系换算成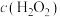 计。
计。
以 为例,说明当其中氧化剂浓度大于
为例,说明当其中氧化剂浓度大于 时,Pt的浸出率降低的原因:随着
时,Pt的浸出率降低的原因:随着 增大,其氧化性增强,部分
增大,其氧化性增强,部分 被
被___________ 还原而消耗。
 、
、 )中回收Pt的一种工艺流程如图所示。回答下列问题:
)中回收Pt的一种工艺流程如图所示。回答下列问题:
(1)步骤Ⅰ焙烧的目的是
(2)实验人员采用三种不同的浸出试剂分别研究过程Ⅱ中Pt的浸出率。所用的浸出试剂分别是
 、
、 和
和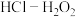 。
。①将下列浸出反应的离子方程式补充完整:




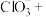
 ___________
___________


②当
 或
或 作为氧化剂浸出等量Pt时,
作为氧化剂浸出等量Pt时,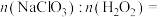
③
 相同、浸出时间相同时,三种浸出试剂对Pt的浸出率如下表所示:
相同、浸出时间相同时,三种浸出试剂对Pt的浸出率如下表所示:| 种类 | 氧化剂浓度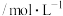 | 0.1 | 0.2 | 0.3 | 0.4 |
| 甲 |  对Pt的浸出率/% 对Pt的浸出率/% | 72.7 | 78.2 | 77.5 | 75.4 |
| 乙 |  对P的浸出率/% 对P的浸出率/% | 79.6 | 85.3 | 82.1 | 81.6 |
| 丙 | 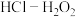 对Pt的浸出率/% 对Pt的浸出率/% | 80.0 | 85.6 | 83.2 | 82.5 |
 按照②中的物质的量关系换算成
按照②中的物质的量关系换算成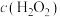 计。
计。 以
 为例,说明当其中氧化剂浓度大于
为例,说明当其中氧化剂浓度大于 时,Pt的浸出率降低的原因:随着
时,Pt的浸出率降低的原因:随着 增大,其氧化性增强,部分
增大,其氧化性增强,部分 被
被
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含Fe3+、Cu2+、Fe2+)回收再生的流程如图。

请回答:
(1)腐蚀池中发生反应的化学方程式是___________ 。
(2)由置换池中得到固体的操作名称是___________ 。
(3)置换池中发生反应的离子方程式有Fe+Cu2+=Fe2++Cu和___________ 。
(4)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是________ 。

请回答:
(1)腐蚀池中发生反应的化学方程式是
(2)由置换池中得到固体的操作名称是
(3)置换池中发生反应的离子方程式有Fe+Cu2+=Fe2++Cu和
(4)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是
您最近一年使用:0次
【推荐3】以工业生产硼砂所得废渣硼镁泥(主要含 MgO、SiO2、Fe2O3,另含少量 FeO、CaO、 Al2O3 、B2O3等)为原料制取 MgSO4·7H2O 的工艺流程如下:
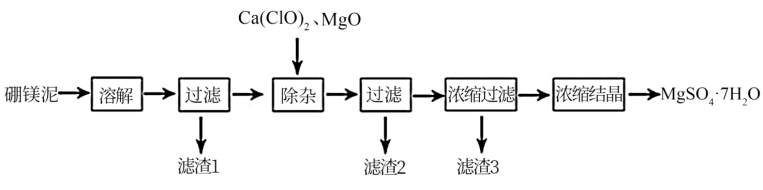
回答下列问题:
(1)过滤需用到的玻璃仪器有玻璃棒、烧杯和_______ ;其中玻璃棒的作用是___________ 。
(2)滤渣 1 中的某种物质 是玻璃的主要成分之一,玻璃另外两种主要成分的化学式为_____________ 。除杂过程加入MgO 的作用是__________________ 。
(3)写出除杂过程中次氯酸钙将 Fe2+氧化的离子方程式__________________ 。
(4)除杂过程中,当 c(Al3+)=1×10−5 mol/L 时,c(Fe 3+)=__________ mol/L。(已知Ksp [Al(OH)3] = 3.2×10−34 , Ksp[Fe(OH)3]= 1.1×10−36,结果保留两位有效数字 )
(5)滤渣 3 主要成分的化学式是___________ 。

回答下列问题:
(1)过滤需用到的玻璃仪器有玻璃棒、烧杯和
(2)滤渣 1 中的某种物质 是玻璃的主要成分之一,玻璃另外两种主要成分的化学式为
(3)写出除杂过程中次氯酸钙将 Fe2+氧化的离子方程式
(4)除杂过程中,当 c(Al3+)=1×10−5 mol/L 时,c(Fe 3+)=
(5)滤渣 3 主要成分的化学式是
您最近一年使用:0次



