名校
1 . 用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如图所示:
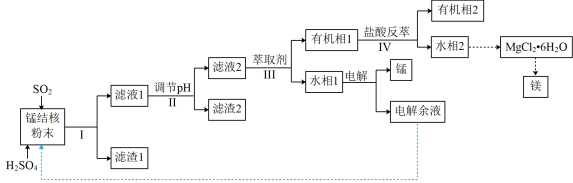
已知:①几种难溶物的溶度积(25℃)如下表所示。
②溶液中某离子浓度≤1.0×10-6mol•L-1时,认为该离子沉淀完全。
完成下列问题:
(1)Mn在周期表中的位置:___________ 。
(2)“滤液1”中c(Mn2+)为0.18mol•L-1,则“调节pH”的范围为___________ ,“滤渣2”的成分为___________ 。
(3)“Ⅲ”处“萃取剂”萃取的成分是___________ 。
(4)MgCl2•6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为___________ 。
(5)水相1发生电解反应的离子方程式为:___________ 。
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式___________ 。


已知:①几种难溶物的溶度积(25℃)如下表所示。
| 化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
| Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
完成下列问题:
(1)Mn在周期表中的位置:
(2)“滤液1”中c(Mn2+)为0.18mol•L-1,则“调节pH”的范围为
(3)“Ⅲ”处“萃取剂”萃取的成分是
(4)MgCl2•6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为
(5)水相1发生电解反应的离子方程式为:
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式

您最近一年使用:0次
名校
2 . 用丙烯腈(CH2=CHCN)电合成己二腈[NC(CH2)4CN]的原理如图。下列说法不正确的是
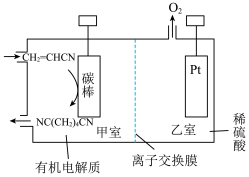

| A.碳棒电极连接外电源的正极 |
| B.阳极电极反应式:2H2O-4e-=O2↑+4H+ |
| C.离子交换膜为质子交换膜 |
| D.CH2=CHCN发生还原反应 |
您最近一年使用:0次
名校
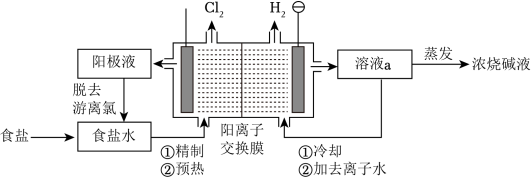
3 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:________ ,开始时_________ 极(阴、阳)碱性增强。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为___________ 。
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为___________ 。
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为___________ ,根据原子的性质分析上述判断的理由:___________ 。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为
您最近一年使用:0次
2024-02-10更新
|
162次组卷
|
3卷引用:吉林省长春市东北师大附属中学2023-2024学年高二上学期 期末化学试卷
解题方法
4 . 氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法不正确的是
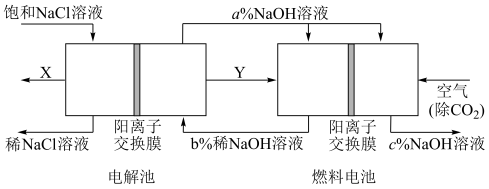

| A.通入空气的电极为正极 |
| B.电解池中产生2 mol Cl2时,理论上燃料电池中消耗1molO2 |
C.电解池的阴极反应式为 |
| D.a、b、c的大小关系为a>b=c |
您最近一年使用:0次
名校
解题方法
5 . 电化学原理在工农业生产中有重要应用。已知甲醇是一种重要的清洁高能燃料,根据如图所示装置完成下列各小题。( 均为石墨电极,假设各装置在工作过程中溶液体积不变,且电解质溶液均足量)。
均为石墨电极,假设各装置在工作过程中溶液体积不变,且电解质溶液均足量)。
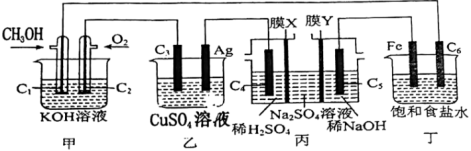
(1)甲装置中 电极上的电极反应式为
电极上的电极反应式为________ 。
(2)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气, 向
向________ (填“ ”或“
”或“ ”)移动,当电极上通过0.04mol电子时,
”)移动,当电极上通过0.04mol电子时, 电极上生成
电极上生成________ L气体(标准状况下)。
(3)丁装置中电解反应的总化学方程式为________ 。
(4)乙装置________ (填“是”或“不是”)电镀池。若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时,溶液质量________ (填“增加”或“减轻”)________ g。
(5)反应一段时间后,下列物质能使乙池恢复到反应前浓度的是________ (填选项字母)。
A.Cu B.CuO C.
 均为石墨电极,假设各装置在工作过程中溶液体积不变,且电解质溶液均足量)。
均为石墨电极,假设各装置在工作过程中溶液体积不变,且电解质溶液均足量)。
(1)甲装置中
 电极上的电极反应式为
电极上的电极反应式为(2)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,
 向
向 ”或“
”或“ ”)移动,当电极上通过0.04mol电子时,
”)移动,当电极上通过0.04mol电子时,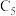 电极上生成
电极上生成(3)丁装置中电解反应的总化学方程式为
(4)乙装置
(5)反应一段时间后,下列物质能使乙池恢复到反应前浓度的是
A.Cu B.CuO C.

您最近一年使用:0次
名校
解题方法
6 . 氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石(主要成分为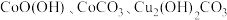 和
和 ,还有
,还有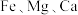 的氧化物)为原料制备氧化钴的工艺流程如图所示:
的氧化物)为原料制备氧化钴的工艺流程如图所示:

已知:常温下 ;
; 完全沉淀的pH约为3.2。
完全沉淀的pH约为3.2。
请回答下列问题:
(1)“浸泡”过程中,所得滤渣1中的物质是___________ ,写出此过程中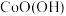 与
与 反应的离子方程式
反应的离子方程式___________ 。
(2)“除铜”过程中需加入FeS固体,写出该过程发生反应的离子方程式___________ 。
(3)为检验除铜后滤液中是否含有 ,取少量滤液,滴加2滴。K3[Fe(CN)6]溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:
,取少量滤液,滴加2滴。K3[Fe(CN)6]溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:___________ 。
(4)过程I加入 溶液调节
溶液调节 至4.0左右,其目的为
至4.0左右,其目的为___________ 。
(5)已知某温度下 。该温度下,步骤Ⅱ中加入足量的
。该温度下,步骤Ⅱ中加入足量的 溶液可将
溶液可将 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中 ,则滤液中
,则滤液中 为
为___________ 。
(6)工业上采取电解精炼制取 时,常选用COCl2为电解质溶液进行电解,“粗钴”应与电源
时,常选用COCl2为电解质溶液进行电解,“粗钴”应与电源___________ (填“正”或“负”)极相连,另一极为石墨电极,则阴极的电极反应为___________ ;Co元素位于元素周期表的___________ 区。
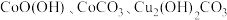 和
和 ,还有
,还有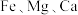 的氧化物)为原料制备氧化钴的工艺流程如图所示:
的氧化物)为原料制备氧化钴的工艺流程如图所示:
已知:常温下
 ;
; 完全沉淀的pH约为3.2。
完全沉淀的pH约为3.2。请回答下列问题:
(1)“浸泡”过程中,所得滤渣1中的物质是
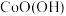 与
与 反应的离子方程式
反应的离子方程式(2)“除铜”过程中需加入FeS固体,写出该过程发生反应的离子方程式
(3)为检验除铜后滤液中是否含有
 ,取少量滤液,滴加2滴。K3[Fe(CN)6]溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:
,取少量滤液,滴加2滴。K3[Fe(CN)6]溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:(4)过程I加入
 溶液调节
溶液调节 至4.0左右,其目的为
至4.0左右,其目的为(5)已知某温度下
 。该温度下,步骤Ⅱ中加入足量的
。该温度下,步骤Ⅱ中加入足量的 溶液可将
溶液可将 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中 ,则滤液中
,则滤液中 为
为(6)工业上采取电解精炼制取
 时,常选用COCl2为电解质溶液进行电解,“粗钴”应与电源
时,常选用COCl2为电解质溶液进行电解,“粗钴”应与电源
您最近一年使用:0次
7 . 将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:

已知:①Mn的金属活动性强于Fe, 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。
②相关物质的 数据如表所示。
数据如表所示。
回答下列问题:
(1)为加快“还原焙烧”时的反应速率,可采取的措施有_______ (填一条),该过程中生成的气体产物有 、
、 和
和________ (填化学式);“酸浸”后分离出滤渣1的操作名称为_________ 。
(2)已知,“净化”时溶液中 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
___________ 。
(3)通过“电解”滤液2制备 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将___________ (填“增大”或“减小”)。
(4) 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
___________ {已知: 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。
(5)在 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)=___________ ;以石墨和 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为___________ ,若此时电路中转移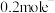 ,则石墨电极将增重
,则石墨电极将增重___________ g。
 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:
已知:①Mn的金属活动性强于Fe,
 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。②相关物质的
 数据如表所示。
数据如表所示。| 化合物 |  |  |  |
 |  | 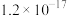 |  |
(1)为加快“还原焙烧”时的反应速率,可采取的措施有
 、
、 和
和(2)已知,“净化”时溶液中
 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
(3)通过“电解”滤液2制备
 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将(4)
 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。(5)在
 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)= 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为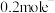 ,则石墨电极将增重
,则石墨电极将增重
您最近一年使用:0次
2023-07-10更新
|
170次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2022-2023学年高二下学期7月期末考试化学试题
解题方法
8 . 如图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是
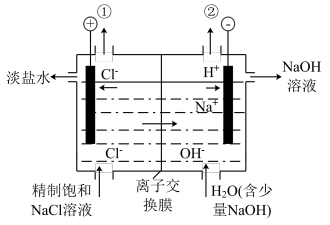

| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜为阳离子交换膜 |
C.装置中发生反应的离子方程式为2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
您最近一年使用:0次
名校
解题方法
9 . 关于下列各装置图的叙述正确的是
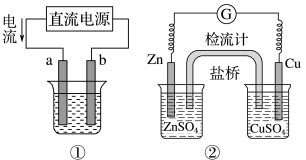
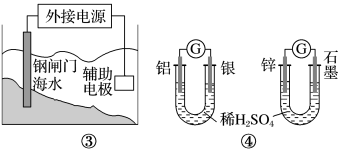
A.用图①装置实现铁上镀铜,b极为铁,电解质溶液可以是 溶液 溶液 |
B.图②装置盐桥中 的 的 移向左烧杯 移向左烧杯 |
| C.图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法 |
| D.图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同 |
您最近一年使用:0次
2023-03-02更新
|
354次组卷
|
5卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
解题方法
10 . 用惰性电极电解足量的 溶液,下列说法中不正确的是
溶液,下列说法中不正确的是
 溶液,下列说法中不正确的是
溶液,下列说法中不正确的是A.阴极发生的电极反应为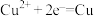 |
B.阳极发生的电极反应为 |
C.恰好电解完时,加入一定量的 可恢复到原浓度 可恢复到原浓度 |
D.若有6.4g金属Cu析出,放出的 为0.05mol 为0.05mol |
您最近一年使用:0次



