1 . 某学校兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
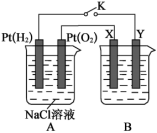
(1)通 的
的 电极为
电极为___________ 极(填电极名称),其电极反应式为___________ 。
(2)若B电池为电镀池,X、Y为质量相同的不含杂质的两电极,电解质溶液为 溶液,目的是在某铁镀件上镀一层铜,则X电极材料为
溶液,目的是在某铁镀件上镀一层铜,则X电极材料为___________ ,Y电极的反应式为___________ 。若A池中消耗准状况下 的
的 ,则B池中两电极的质量相差
,则B池中两电极的质量相差___________ g。
(3)若B电池为精炼铜,且粗铜中含有 、
、 、
、 、
、 等杂质,在
等杂质,在___________ 。电极(填“X”或“Y”)周围有固体沉积。
(4)若X、Y均为 电池的电解质溶液为
电池的电解质溶液为 的
的 溶液,当电池工作一段时间后,B电池溶液的
溶液,当电池工作一段时间后,B电池溶液的 将
将___________ (填“增大”“减小”或“不变”),要使该溶液恢复到原来的状态,需加入___________ 。
(5)若X、Y均是铜,电解质溶液为 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为___________ 。

(1)通
 的
的 电极为
电极为(2)若B电池为电镀池,X、Y为质量相同的不含杂质的两电极,电解质溶液为
 溶液,目的是在某铁镀件上镀一层铜,则X电极材料为
溶液,目的是在某铁镀件上镀一层铜,则X电极材料为 的
的 ,则B池中两电极的质量相差
,则B池中两电极的质量相差(3)若B电池为精炼铜,且粗铜中含有
 、
、 、
、 、
、 等杂质,在
等杂质,在(4)若X、Y均为
 电池的电解质溶液为
电池的电解质溶液为 的
的 溶液,当电池工作一段时间后,B电池溶液的
溶液,当电池工作一段时间后,B电池溶液的 将
将(5)若X、Y均是铜,电解质溶液为
 溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是
溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是 ,试写出该电极发生的电极反应式为
,试写出该电极发生的电极反应式为
您最近一年使用:0次
解题方法
2 . 为实现“碳达峰”,我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
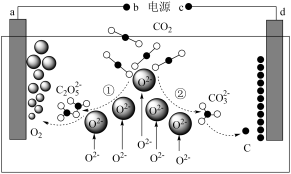
下列说法不正确的是

下列说法不正确的是
| A.b为电源的正极,a为电解池的阳极 |
B.a极的电极反应式为 |
C.过程①中捕获 时碳的化合价未发生变化,过程②中捕获 时碳的化合价未发生变化,过程②中捕获 时碳的化合价发生了变化 时碳的化合价发生了变化 |
D.上述装置中总反应的化学方程式为 |
您最近一年使用:0次
3 . 一种电催化合成氨的装置如图所示。下列说法正确的是
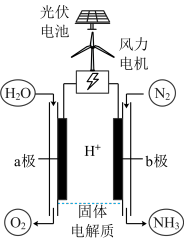

| A.a电极与外电源的负极相连 |
B.a、b两极产生的气体的物质的量之比为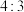 |
| C.a、b两极之间可以加一个阴离子交换膜 |
D.b极上发生的主要反应为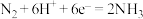 |
您最近一年使用:0次
名校
解题方法
4 . 基于甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,从而实现了碳和水的零排放方式生产氢气。电化学反应机理如下图所示下列说法错误的是


A.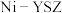 电极为阳极, 电极为阳极, 电极为阴极 电极为阴极 |
B.阳极的电极反应式为 |
C.电解的总反应为 |
| D.上述电化学装置中的电解质溶液可换为水 |
您最近一年使用:0次
名校
5 . 在电场作用下双极膜能将 解离成
解离成 和
和 。利用双极膜电渗析法制备乳酸(
。利用双极膜电渗析法制备乳酸(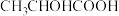 ,简写为HR)的原理如图所示。
,简写为HR)的原理如图所示。
 解离成
解离成 和
和 。利用双极膜电渗析法制备乳酸(
。利用双极膜电渗析法制备乳酸(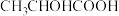 ,简写为HR)的原理如图所示。
,简写为HR)的原理如图所示。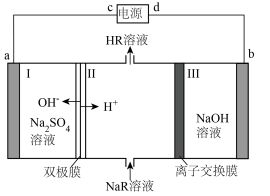
| A.b电极发生氧化反应 |
| B.装置中离子交换膜为阳离子交换膜 |
| C.a电极的电势低于b电极 |
| D.当a电极生成1mol气体时,理论上可生成2mol乳酸 |
您最近一年使用:0次
2023-12-24更新
|
255次组卷
|
4卷引用:广西柳州市民族高中2023-2024学年高二上学期期末五校联考模拟考化学试题
解题方法
6 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺节能超过30%。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。

(1)图中X、Y分别是_______ 、__________ 填化学式);X可用于制取84消毒液,请写出离子方程式________ 。
(2)燃料电池B中的负极反应式为:______ ,判断正极附近溶液的pH将______ (选择“增大”、“减小”、“不变”填空)。
(3)标准状况下,当A池中生成22.4L氢气时,电路中转移的电子数为__________ 。
(4)如图所示装置,用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极上产生ClO2的电极反应式:________ 。


(1)图中X、Y分别是
(2)燃料电池B中的负极反应式为:
(3)标准状况下,当A池中生成22.4L氢气时,电路中转移的电子数为
(4)如图所示装置,用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极上产生ClO2的电极反应式:

您最近一年使用:0次
7 . 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇涉及的反应可表示为:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
②CO(g)+2H2(g) CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
(1)根据上述反应求:④CO(g)+H2O(g) CO2(g)+H2(g)的△H4=
CO2(g)+H2(g)的△H4=___________ kJ•mol-1。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
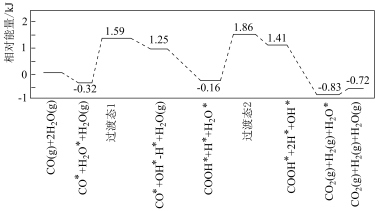
写出该历程中决速步骤的化学方式:___________ 。
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于反应CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
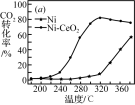
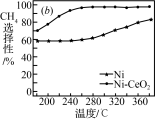
(3)高于320℃后,以Ni为催化剂,CO2转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
Ⅲ.电化学应用
(5)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
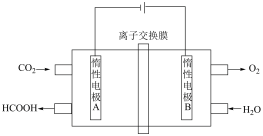
则A极的电极反应式为___________ 。以铅蓄电池为电源进行电解,理论上当有1mol HCOOH生成时,铅蓄电池中消耗H2SO4___________ mol。
Ⅰ.二氧化碳加氢制甲醇涉及的反应可表示为:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49kJ•mol-1(1)根据上述反应求:④CO(g)+H2O(g)
 CO2(g)+H2(g)的△H4=
CO2(g)+H2(g)的△H4=(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方式:
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:

(3)高于320℃后,以Ni为催化剂,CO2转化率仍在上升,其原因是
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
Ⅲ.电化学应用
(5)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:

则A极的电极反应式为
您最近一年使用:0次
8 . 五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料(主要为V2O3,还含有少量 FeO、CuO、MnO、SiO2、Al2O3、有机物)为原料制备 V2O5的一种流程如图:
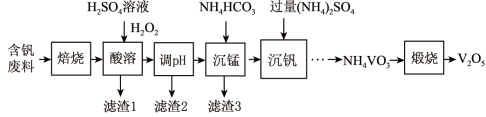
已知:①NH4VO3可溶于热水。
②25℃时,难溶电解质的溶度积常数如表所示:
(1)“焙烧”的主要目的是___________________ 。
(2)滤渣 2 的成分为___________________ 。
(3)“沉锰”需将温度控制在 70℃左右,温度不能过高或过低的原因为___________________ ;“沉锰”的离子反应方程式为___________________ 。
(4)“沉钒”得到偏钒酸铵(NH4VO3),若“沉钒”前溶液中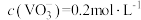 ,不考虑溶液体积变化,为使钒元素的沉降率达到 98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到 98%,至少应调节 为
为___________ mol·L-1。
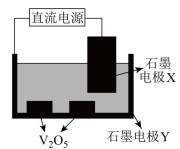
(5)将制得的V2O5通过电解的方法制备金属钒,以熔融CaO为电解质的电解装置如图:石墨电极X接直流电源的___________________ (填“正极” 或“负极”),阴极反应式为 ___________________ 。

已知:①NH4VO3可溶于热水。
②25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | NH4VO3 |
| KSP | 2.2×10-20 | 4×10-14 | 1.9×10-33 | 1.1×10-36 | 1.64×10-14 | 1.6×10-3 |
(2)滤渣 2 的成分为
(3)“沉锰”需将温度控制在 70℃左右,温度不能过高或过低的原因为
(4)“沉钒”得到偏钒酸铵(NH4VO3),若“沉钒”前溶液中
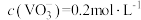 ,不考虑溶液体积变化,为使钒元素的沉降率达到 98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到 98%,至少应调节 为
为(5)将制得的V2O5通过电解的方法制备金属钒,以熔融CaO为电解质的电解装置如图:石墨电极X接直流电源的

您最近一年使用:0次
名校
解题方法
9 . 在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是
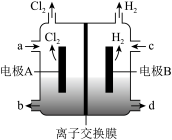

| A.电极 A 为阳极,发生氧化反应 |
| B.离子交换膜为阳离子交换膜 |
C.电解饱和食盐水的离子方程式为:  |
| D.NaOH 溶液从 d 处出 |
您最近一年使用:0次
10 . 将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:

已知:①Mn的金属活动性强于Fe, 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。
②相关物质的 数据如表所示。
数据如表所示。
回答下列问题:
(1)为加快“还原焙烧”时的反应速率,可采取的措施有_______ (填一条),该过程中生成的气体产物有 、
、 和
和________ (填化学式);“酸浸”后分离出滤渣1的操作名称为_________ 。
(2)已知,“净化”时溶液中 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
___________ 。
(3)通过“电解”滤液2制备 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将___________ (填“增大”或“减小”)。
(4) 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
___________ {已知: 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。
(5)在 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)=___________ ;以石墨和 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为___________ ,若此时电路中转移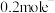 ,则石墨电极将增重
,则石墨电极将增重___________ g。
 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如图:
的一种工艺流程如图:
已知:①Mn的金属活动性强于Fe,
 在酸性条件下比较稳定,pH大于5.5时易被氧化。
在酸性条件下比较稳定,pH大于5.5时易被氧化。②相关物质的
 数据如表所示。
数据如表所示。| 化合物 |  |  |  |
 |  | 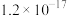 |  |
(1)为加快“还原焙烧”时的反应速率,可采取的措施有
 、
、 和
和(2)已知,“净化”时溶液中
 、
、 的物质的量浓度均约为
的物质的量浓度均约为 ,当金属离子的浓度小于
,当金属离子的浓度小于 时可认为该离子完全沉淀,则“净化”时调节
时可认为该离子完全沉淀,则“净化”时调节 的合理范围是
的合理范围是
(3)通过“电解”滤液2制备
 和
和 ,若电路中转移
,若电路中转移 电子,溶液的
电子,溶液的 将
将(4)
 为两性氢氧化物,可溶于
为两性氢氧化物,可溶于 溶液,反应为
溶液,反应为
 ,其平衡常数
,其平衡常数
 的平衡常数称为稳定平衡常数,
的平衡常数称为稳定平衡常数, 。
。(5)在
 条件下,
条件下, 和
和 按4:1的物质的量比发生反应制得
按4:1的物质的量比发生反应制得 ,同时产物还有
,同时产物还有 和
和 ,则该反应中n(氧化产物):n(还原产物)=
,则该反应中n(氧化产物):n(还原产物)= 为电极材料可制作可充电电池,该电池的总反应为
为电极材料可制作可充电电池,该电池的总反应为 ,充电时
,充电时 电极上发生的电极反应为
电极上发生的电极反应为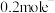 ,则石墨电极将增重
,则石墨电极将增重
您最近一年使用:0次
2023-07-10更新
|
170次组卷
|
4卷引用:广西壮族自治区钦州市2022-2023学年高二下学期期末教学质量监测化学试题



