解题方法
1 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 为原料合成尿素
为原料合成尿素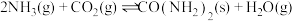
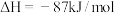 。
。
(1)有利于提高 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步: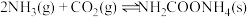

第二步: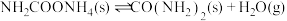


___________  。
。
②决定该反应速率是___________ 反应(填“第一步”或“第二步”),理由是___________ 。
Ⅱ.以和催化重整制备合成气: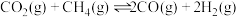 。
。
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应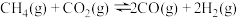 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。___________ (填序号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: D.同时断裂
D.同时断裂 键和
键和 键
键
②由图可知,压强
___________  (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
___________ 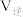 。
。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则
,则 点对应温度下的
点对应温度下的
___________ (用含 的代数式表示)。
的代数式表示)。
Ⅲ.电化学法还原二氧化碳制乙烯
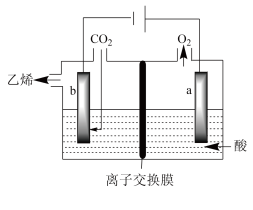
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:___________ 。
I.以
 和
和 为原料合成尿素
为原料合成尿素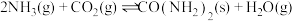
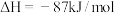 。
。(1)有利于提高
 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步:
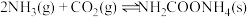

第二步:

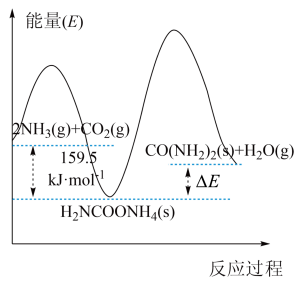

 。
。②决定该反应速率是
Ⅱ.以和催化重整制备合成气:
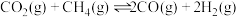 。
。(3)在密闭容器中通入物质的量均为
 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应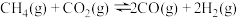 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。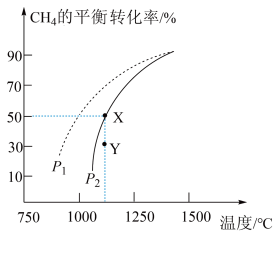
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
 D.同时断裂
D.同时断裂 键和
键和 键
键②由图可知,压强

 (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
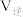 。
。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则
,则 点对应温度下的
点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
您最近一年使用:0次
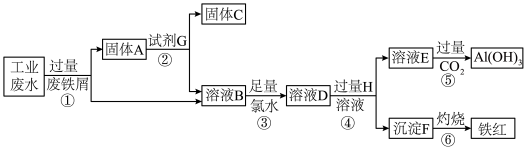
2 . I.某工业废水中含 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择_______ (填序号,下同);试剂H是_______ 。
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为_______ ;反应③的离子方程式为_______ 。
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。
(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应_______ 。
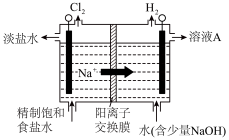
(4)工业常用图装置制备氯气,产生氯气的电极应与电源_______ (选填“正极”或“负极”)相连,发生的电极反应为_______ 。
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应_______ 。
 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。

(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应
(4)工业常用图装置制备氯气,产生氯气的电极应与电源
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应
您最近一年使用:0次
解题方法
3 . 电化学原理在生产生活中应用广泛,下列叙述中错误的是


| A.在总反应为Zn+2H+=Zn2++H2↑的原电池中,正极材料为石墨,稀硝酸作电解质溶液 |
| B.如图:若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| C.电解饱和食盐水一段时间后,可通入HCl气体使溶液复原 |
D.铂作电极,以KOH溶液为电解质溶液的甲烷空气燃料电池,放电时的负极反应式为CH4+10OH--8e-=CO +7H2O +7H2O |
您最近一年使用:0次
4 . 水煤气变换反应 (简称WGS)是重要的化工过程,主要用于合成氨气、制氢气以及合成气加工等工业领域中。
(简称WGS)是重要的化工过程,主要用于合成氨气、制氢气以及合成气加工等工业领域中。
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上WGS的历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

①该反应的决速步骤的化学方程式为_____ 。
②Au属于立方晶型系,晶胞参数为 ,密度为
,密度为 。则
。则 晶胞中含有
晶胞中含有 的原子数为
的原子数为_____ (列出计算式,阿伏加德罗常数的值为 )。
)。
(2)WGS在不同温度下的平衡常数如下表所示。
反应常在较高温度下进行,该措施的优点是反应速率较快,缺点是_____ 。
(3)一定温度下,向恒容密闭容器中充入一定量的 和
和 ,反应后测得各组分的平衡压强(即组分的物质的量分数
,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 、
、 和
和 。则反应的平衡常数
。则反应的平衡常数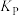 的数值为
的数值为_____ 。维持相同的温度,提高水蒸气的比例,使 的平衡转化率提高到
的平衡转化率提高到 ,则原料气中CO和水蒸气的物质的量之比为
,则原料气中CO和水蒸气的物质的量之比为_____ (不用除出结果,保留整数比即可)。
(4)WGS常在Pd膜反应器中进行,其工作原理如图所示。

利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_____ 。
(5)WGS也可采用电化学方法实现,反应装置如图所示。

①出口2的气体成分,除了 还有
还有_____ (填化学式)。
②阳极的反应式为_____ 。
 (简称WGS)是重要的化工过程,主要用于合成氨气、制氢气以及合成气加工等工业领域中。
(简称WGS)是重要的化工过程,主要用于合成氨气、制氢气以及合成气加工等工业领域中。(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上WGS的历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

①该反应的决速步骤的化学方程式为
②Au属于立方晶型系,晶胞参数为
 ,密度为
,密度为 。则
。则 晶胞中含有
晶胞中含有 的原子数为
的原子数为 )。
)。(2)WGS在不同温度下的平衡常数如下表所示。
| 温度/℃ | 700 | 800 | 830 | 1000 |
| 平衡常数 |  |  |  |  |
(3)一定温度下,向恒容密闭容器中充入一定量的
 和
和 ,反应后测得各组分的平衡压强(即组分的物质的量分数
,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 、
、 和
和 。则反应的平衡常数
。则反应的平衡常数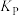 的数值为
的数值为 的平衡转化率提高到
的平衡转化率提高到 ,则原料气中CO和水蒸气的物质的量之比为
,则原料气中CO和水蒸气的物质的量之比为(4)WGS常在Pd膜反应器中进行,其工作原理如图所示。

利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是
(5)WGS也可采用电化学方法实现,反应装置如图所示。

①出口2的气体成分,除了
 还有
还有②阳极的反应式为
您最近一年使用:0次
名校
解题方法
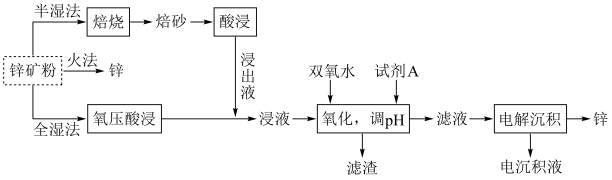
5 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:
已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
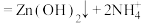 ,
,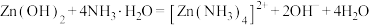 。
。
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
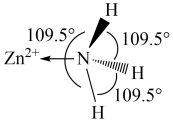
(1)已知 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则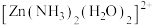 有
有_____ 种结构。 分子中的
分子中的 键角比
键角比 中的小的原因是
中的小的原因是_______ 。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,∙∙∙∙∙∙然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红∙∙∙∙∙∙冷定,毁罐取出。∙∙∙∙∙∙即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的_______ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是_______ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为_________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为________ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫_______ 。
(6)通常认为离子浓度 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算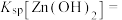
_____ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
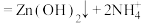 ,
,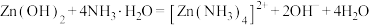 。
。②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
(1)已知
 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则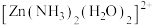 有
有 分子中的
分子中的 键角比
键角比 中的小的原因是
中的小的原因是
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,∙∙∙∙∙∙然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红∙∙∙∙∙∙冷定,毁罐取出。∙∙∙∙∙∙即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算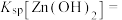
您最近一年使用:0次
2024-02-25更新
|
157次组卷
|
3卷引用:云南省楚雄彝族自治州2023-2024学年高三上学期1月期末考试理综化学试题
名校
解题方法
6 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含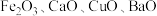 )为原料回收镍,工艺流程如下图所示。
)为原料回收镍,工艺流程如下图所示。

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如下表。
如下表。
回答下列问题:
(1)浸出渣主要成分为___________ (填化学式)。
(2)“除铜”时,写出生成 的离子方程式
的离子方程式___________ 。
(3)“氧化”的目的是将溶液中 氧化为
氧化为 ,温度需控制在
,温度需控制在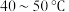 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)通过“电解”可以制得 ,阳极的电极反应式为
,阳极的电极反应式为___________ 。
(6)用可溶性碳酸盐,可以浸取 固体,在溶液浸取过程中会发生反应:
固体,在溶液浸取过程中会发生反应: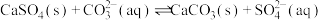 。已知:
。已知: 时,
时,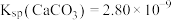 ,
,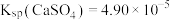 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为___________ 。
(7)保持其他条件不变,在不同温度下对含镍废催化剂进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度和时间分别为___________  、
、___________  。
。

 ,另含
,另含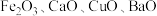 )为原料回收镍,工艺流程如下图所示。
)为原料回收镍,工艺流程如下图所示。
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的
 如下表。
如下表。| 氢氧化物 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.7 |
沉淀完全的 | 3.7 | 9.7 | 9.2 |
(1)浸出渣主要成分为
(2)“除铜”时,写出生成
 的离子方程式
的离子方程式(3)“氧化”的目的是将溶液中
 氧化为
氧化为 ,温度需控制在
,温度需控制在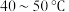 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)通过“电解”可以制得
 ,阳极的电极反应式为
,阳极的电极反应式为(6)用可溶性碳酸盐,可以浸取
 固体,在溶液浸取过程中会发生反应:
固体,在溶液浸取过程中会发生反应: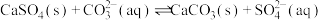 。已知:
。已知: 时,
时,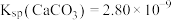 ,
,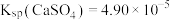 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为(7)保持其他条件不变,在不同温度下对含镍废催化剂进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度和时间分别为
 、
、 。
。
您最近一年使用:0次
解题方法
7 . 下列离子方程式书写正确的是
A. 溶液中通入足量氯气: 溶液中通入足量氯气: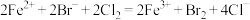 |
B. 溶液与足量 溶液与足量 溶液反应: 溶液反应: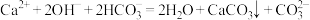 |
C.漂白液吸收少量 气体: 气体: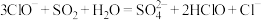 |
D.用惰性电极电解 溶液: 溶液: |
您最近一年使用:0次
名校
8 . 电解脱硫的基本原理如图所示,下列有关说法错误的是

A.阴极电极反应为 |
B.生成1  ,消耗15 ,消耗15  |
C.电解过程中混合溶液的 增大 增大 |
D.电解过程中 向石墨a电极移动 向石墨a电极移动 |
您最近一年使用:0次
2023-11-12更新
|
271次组卷
|
3卷引用:云南省曲靖市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 近日,哈尔滨工业大学的研究团队发现,以非晶态 (Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
(Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:

下列说法正确的是
 (Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
(Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
下列说法正确的是
A.电解过程中,电极 附近溶液的 附近溶液的 不变 不变 |
B.非晶态 (Ⅲ)基硫化物能改变OER反应的反应热 (Ⅲ)基硫化物能改变OER反应的反应热 |
| C.OER分四步进行,其中没有非极性键的形成与断裂 |
D.UOR的电化学反应总过程为 |
您最近一年使用:0次
2023-10-06更新
|
1022次组卷
|
9卷引用:云南省昆明市第八中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
10 . 下列实验现象描述及有关离子方程式书写都合理的是
A.向 溶液中加入 溶液中加入 至溶液呈中性的离子方程式: 至溶液呈中性的离子方程式: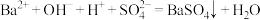 |
B.向含有淀粉的 溶液中滴入 溶液中滴入 溶液,溶液变为蓝色: 溶液,溶液变为蓝色: |
C.向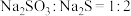 的溶液中滴加稀盐酸: 的溶液中滴加稀盐酸: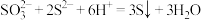 |
D.用铁作电极电解饱和食盐水: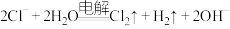 |
您最近一年使用:0次
2023-08-23更新
|
156次组卷
|
2卷引用:云南省保山市2020-2021学年高二下学期期末考试化学试题



