已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
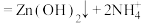 ,
,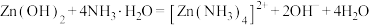 。
。②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
(1)已知
 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则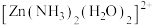 有
有 分子中的
分子中的 键角比
键角比 中的小的原因是
中的小的原因是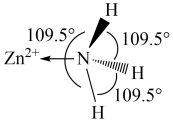
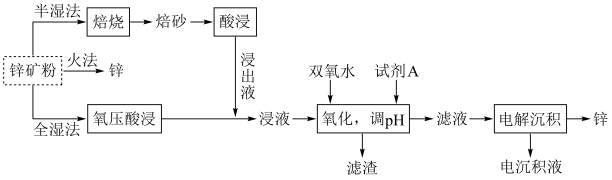
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,∙∙∙∙∙∙然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红∙∙∙∙∙∙冷定,毁罐取出。∙∙∙∙∙∙即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算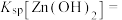
相似题推荐
软锰矿:
 含量
含量 ,
, 含量约20%,
含量约20%, 含量约4%,其余为水分;
含量约4%,其余为水分;闪锌矿:
 含量
含量 ,
, 、
、 、
、 含量约7%,其余为水分。
含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
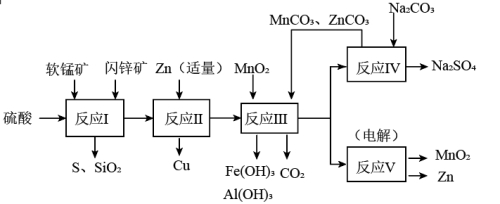
请回答下列问题:
(1)反应I的滤液中含有
 、
、 、
、 、
、 、
、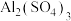 等。试完成反应I中生成
等。试完成反应I中生成 和
和 的化学方程式:
的化学方程式: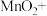
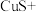 ____=____
____=____
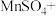
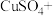 ____,
____,(2)反应II加入适量锌的作用是
(3)反应III中加入
 的作用是
的作用是 、
、 调节溶液的pH,则调节的pH范围是
调节溶液的pH,则调节的pH范围是| 沉淀物 |  |  |  |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
 、
、 和
和(5)已知常温下
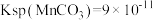 ,
,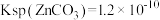 ,若反应Ⅲ之后的混合溶液中
,若反应Ⅲ之后的混合溶液中 、
、 的物质的量浓度相同,将碳酸钠溶液滴入该混合溶液中,当
的物质的量浓度相同,将碳酸钠溶液滴入该混合溶液中,当 开始沉淀时,溶液中
开始沉淀时,溶液中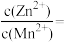
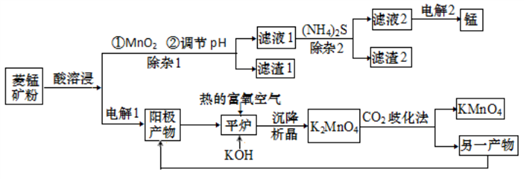
已知 25 ℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是
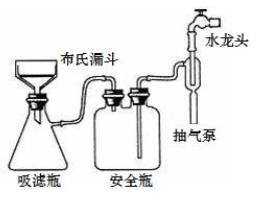
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式
| 化学式 | CH3COOH | NH3·H2O | HClO | H2CO3 | HCOOH |
| Ka | Ka=1.8 × 10-5 | Kb=1.8× 10-5 | Ka=3.0× 10-8 | Ka1=4.1× 10-7 Ka2=5.6× 10-11 | Ka=1.77× 10-4 |
(1)pH相同的NaClO和CH3COOK的两溶液中:c(Na+)—c(ClO—)
(2)由表格中的数据判断下列离子方程式不正确的是
a.2ClO—+H2O+CO2=2HClO+CO
 b.HCOOH+ CO
b.HCOOH+ CO =HCOO—+ HCO
=HCOO—+ HCO
c.HCOOH+CH3COO—=HCOO—+CH3COOH d.Cl2+H2O+2 CO
 =2 HCO
=2 HCO +Cl—+ClO—
+Cl—+ClO—(3)硫酸肼(N2H6SO4)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似,写出硫酸肼第一步水解反应的离子方程式:
(4)25°C,在0.1mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2—)关系如图(忽略溶液体积的变化、H2S的挥发)。某溶液含1.000mol·L-1Mn2+、 0.10mol·L-1H2S,当溶液pH=

Ⅰ.传统的“哈伯法”反应原理为:
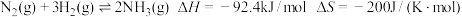
(1)上述反应在常温下
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了
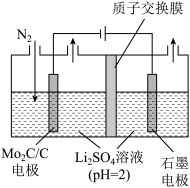
(3)t℃时向2L的某刚性容器中充入
 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为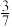 ,则该反应的平衡常数
,则该反应的平衡常数
Ⅱ.“哈伯法”的原料
 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:
(5)下表为不同电压下进行电解时
 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)①表中
 的最大产率=
的最大产率=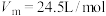 ,结果保留3位有效数值)
,结果保留3位有效数值) ②较高电压下
 的生成速率下降的原因是:
的生成速率下降的原因是:| 电压V |  通入速率mL/min 通入速率mL/min |  生成速率mL/min 生成速率mL/min |  生成速率mg/min 生成速率mg/min |
| 0.2 | 25 | 0.015 | 0.51 |
| 0.3 | 25 | 0.038 | 0.68 |
| 0.4 | 25 | 0.095 | 0.65 |
| 0.5 | 25 | 0.11 | 0.52 |
(6)如图为
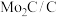 电极表面“
电极表面“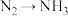 ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为: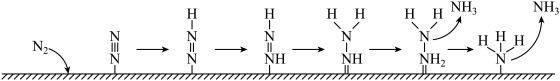
 的再利用研究成为目前的科学领域内的一个重点研究问题。
的再利用研究成为目前的科学领域内的一个重点研究问题。I.天津大学化学团队以
 与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。
与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。
(1)A极为电源的
(2)阳极的电极反应式为
II.在传统的热化学研究中,CO、
 与
与 反应分别存在如下平衡:
反应分别存在如下平衡:①


②

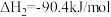
若在反应容器中加入氧化钴(CoO)和金属钴,则会新增如下两个平衡:
③

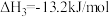
④
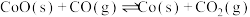
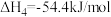
(3)实验测得,上述4个反应平衡常数的lgK随温度变化关系的如图所示,反应①对应的是图中曲线

(4)在不同温度下,按照
 投料,只发生反应①,测得
投料,只发生反应①,测得 的平衡转化率如图所示。图中
的平衡转化率如图所示。图中
 (填“>”或“<”);出现
(填“>”或“<”);出现 突然增大的可能原因是
突然增大的可能原因是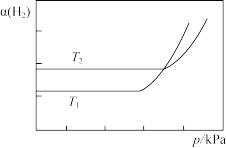
(5)不同压强下,依然按照
 投料,发生反应①和②,测得甲醇的平衡产率、
投料,发生反应①和②,测得甲醇的平衡产率、 的平衡转化率如图甲、乙所示。由图甲可知
的平衡转化率如图甲、乙所示。由图甲可知
 (填“>”或“<”);图乙中
(填“>”或“<”);图乙中 温度时,两条曲线相交于一点的可能原因是
温度时,两条曲线相交于一点的可能原因是
(6)某温度下,在某恒容容器中充入1mol CO2和3mol H2,并加入足量的氧化钴,发生反应①、③和④;反应达平衡时测得气体中,水蒸气、 CO2的体积分数分别为0.30、0.10,则反应①的平衡常数K1=
(1)写出铜溶于上述混合溶液的离子方程式:
(2)若在如图1所示的装置中发生了(1)中的反应,则X电极是

(3)铜片完全溶解时,所得溶液中Fe3+、Cu2+、H+的浓度均为0.2mol/L(假设溶液体积不变),现用电解的方法回收铜,装置如图2所示。
①电解开始阶段,阳极的电极反应式为
②判断溶液中的Cu2+已完全析出的现象是
(1)基态Fe原子价电子轨道表示式为
(2)已知铜的配合物A的结构简式如图所示。
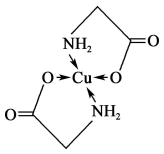
①该配合物中
 的配位数为
的配位数为②配体氨基乙酸根(
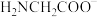 )受热分解可产生
)受热分解可产生 和
和 ,
, 的VSEPR模型名称为
的VSEPR模型名称为(3)亚铁氰化钾,化学式为
 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。 中配体
中配体 的配位原子是
的配位原子是 中C原子的杂化方式为
中C原子的杂化方式为 中
中 键和
键和 键的数目之比为
键的数目之比为(4)
 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。则
所构成的四面体中心,晶胞的侧视图如图2所示。则 配位数为
配位数为 的原子分数坐标为
的原子分数坐标为
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:(1)基态
 原子的价电子排布图(轨道表示式)为
原子的价电子排布图(轨道表示式)为(2)铬和锰基态原子核外未成对电子数之比为
(3)已知:二甲基亚砜能够与水和丙酮(
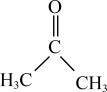 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为
②丙酮分子中各原子电负性由大到小的顺序为
③二甲基亚砜易溶于水,原因可能为
(4)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为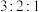 ,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)已知硫化锰(
 )晶胞如图所示,该晶胞参数
)晶胞如图所示,该晶胞参数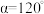 ,
,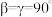 。
。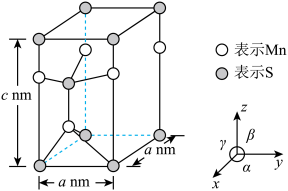
①该晶体中,锰原子周围的硫原子数目为
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
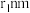 和
和 ,该晶体中原子的空间利用率为(列出计算式即可)
,该晶体中原子的空间利用率为(列出计算式即可)【推荐3】《旧唐书·舆服志》中关于白铜的记载:“自馀一品乘白铜饰犊车”,古时云南所产的镍白铜(铜镍合金)最为有名,称为“云白铜”,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)基态Cu原子的核外电子排布式为[Ar]
(2)向CuSO4溶液中逐滴加入氨水,首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液。
①在[Cu(NH3)4]2+中 Cu2+和NH3之间形成的化学键为
②[Cu(NH3)4]SO4中含有的四种非金属元素中电负性最大的是 、SO2、SO3三种微粒中,中心原子价层电子对数不同于其他微粒的是
、SO2、SO3三种微粒中,中心原子价层电子对数不同于其他微粒的是
③在[Cu(NH3)4]SO4中,NH3的中心原子的杂化轨道类型为
(3)某镍白铜合金的立方晶胞结构如图所示。

①在镍白铜合金中金属原子的堆积方式为
②若合金晶胞密度为 d g·cm-3,阿伏加德罗常数为NA,则晶胞边长为
 催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 ,主反应为:
,主反应为: ;已知:偏钒酸铵
;已知:偏钒酸铵 本身在水中溶解度不大,草酸
本身在水中溶解度不大,草酸 能与含钒粒子形成易溶于水的物质。
能与含钒粒子形成易溶于水的物质。(1)催化剂的制备。分别称取定量的
 与
与 混合,加入草酸溶液,在
混合,加入草酸溶液,在 水浴下加热搅拌至完全溶解,加入一定量的
水浴下加热搅拌至完全溶解,加入一定量的 粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到
粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到 催化剂。加入草酸的作用是
催化剂。加入草酸的作用是(2)催化剂的使用。在脱硝过程中,若烟气中含有
 ,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是
,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是(3)催化剂的回收。通过如下工艺流程可以回收其中的金属。
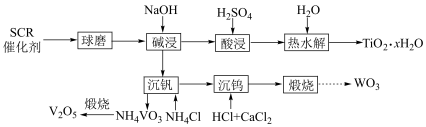
①该流程中钒以
 的形式沉淀出来。沉钒率是指
的形式沉淀出来。沉钒率是指 沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过
沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过 时,沉钒率下降的可能原因是
时,沉钒率下降的可能原因是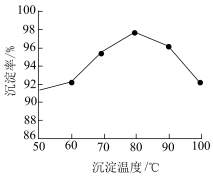
②“酸浸”后钛主要以
 形式存在,“热水解”反应的离子方程式为
形式存在,“热水解”反应的离子方程式为③煅烧
 的化学方程式为
的化学方程式为④为测定回收所得
 样品的纯度,进行如下实验:称取
样品的纯度,进行如下实验:称取 灼烧后的样品,用稀硫酸溶解、定容得到
灼烧后的样品,用稀硫酸溶解、定容得到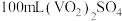 溶液。量取
溶液。量取 溶液放入锥形瓶中,加入过量的
溶液放入锥形瓶中,加入过量的 溶液,再用
溶液,再用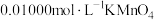 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。已知:
。已知: ;
;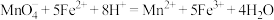 。计算
。计算 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)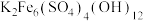 及少量MgO、
及少量MgO、 等。由该废渣回收钢和制备复合镍锌铁氧体(
等。由该废渣回收钢和制备复合镍锌铁氧体(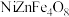 )的流程如下:
)的流程如下:
(1)
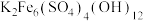 中Fe的化合价为
中Fe的化合价为(2)滤渣1的主要成分为
(3)写出反应II生成沉淀的离子方程式:
(4)滤液中含有的主要阳离子是
(5)
 能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅳ中CuS发生反应的化学方程式:
能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅳ中CuS发生反应的化学方程式: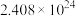 个电子,生成单质硫的质量是
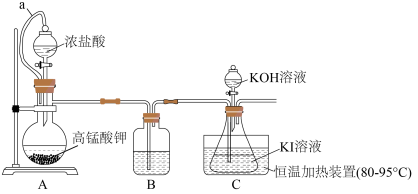
个电子,生成单质硫的质量是方法一:采用如下图所示装置,先用高锰酸钾制备氯气,再用氯气氧化碘化钾得到碘酸钾溶液,最后经一系列步骤得到碘酸钾产品。
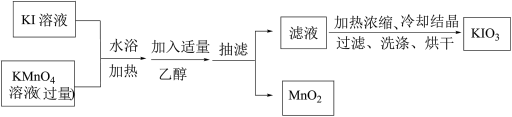
方法二:采用如下图实验流程,直接用高锰酸钾氧化碘化钾得到碘酸钾溶液,再经一系列步骤得到碘酸钾产品。
已知:
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。(1)方法一中,装置A中导管a的作用是
(2)氯气氧化碘化钾得到碘酸钾的离子方程式为
(3)下列叙述正确的是___________(填序号)。
| A.方法一中,装置的设计缺陷是缺少尾气处理装置 |
| B.方法二中,加入适量乙醇的主要作用是除去多余的高锰酸钾 |
| C.方法二中,加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| D.方法二中,为提高洗涤效果,可用热水进行多次洗涤 |
(4)方法二所得产品碘酸钾纯度的测定:准确称取
 产品,配制成
产品,配制成 溶液作为待测液,取
溶液作为待测液,取 该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处
该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处 ,当溶液呈淡黄色时,加入少许指示剂,用
,当溶液呈淡黄色时,加入少许指示剂,用 的硫代硫酸钠标准溶液进行滴定,重复三次,平均消耗标准溶液
的硫代硫酸钠标准溶液进行滴定,重复三次,平均消耗标准溶液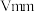 。(已知:
。(已知: )
)①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列,填序号)
________→________→________→装入滴定液至零刻度以上→________→________→________→开始滴定。
A.烘干 B.用蒸馏水洗涤 C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液 E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数 H.检查是否漏水
②滴定指示剂宜选用
③产品碘酸钾的质量分数为
 ]
]


