1 . 利用下列装置(夹持装置略)进行实验,能达到实验目的的是
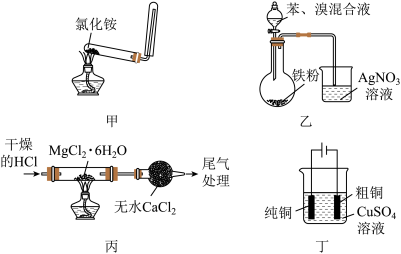

A.用甲装置制备并收集 |
| B.用乙装置制备溴苯并验证有HBr产生 |
C.用丙装置制备无水 |
| D.用丁装置进行铜的电解精炼 |
您最近一年使用:0次
解题方法
2 . 过氧化氢是重要的化工产品,广泛应用于绿色化学合成,医疗消毒等领域。
(1)H2O2的Ka1=2.24×10-12,H2O2的酸性_______ H2O (填“>、<或=”);研究表明,过氧化氢溶液中HO 的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是
的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是_______ 。
(2)早期制备方法:Ba(NO3)2 BaO
BaO BaO2
BaO2
 滤液
滤液 H2O2
H2O2
①II为可逆反应,促进该反应正向进行的措施是_______ 。(写一条)
②III中生成H2O2,反应的化学方程式是_______ 。
(3)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是_______ 。
②下列说法正确的是_______ 。
A.该装置可以实现电能转化为化学能
B.通电后,电极b附近溶液pH增大
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
(4)H2O2含量的测定:已知反应2 +5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现
+5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现_______ 现象时,即为滴定终点。连续进行了三次实验,消耗高锰酸钾溶液的平均体积为20.00mL,计算电解液A的物质的量浓度为_______ 。(计算结果保留两位有效数字)
(1)H2O2的Ka1=2.24×10-12,H2O2的酸性
 的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是
的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是(2)早期制备方法:Ba(NO3)2
 BaO
BaO BaO2
BaO2
 滤液
滤液 H2O2
H2O2①II为可逆反应,促进该反应正向进行的措施是
②III中生成H2O2,反应的化学方程式是
(3)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是
②下列说法正确的是
A.该装置可以实现电能转化为化学能
B.通电后,电极b附近溶液pH增大
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
(4)H2O2含量的测定:已知反应2
 +5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现
+5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现
您最近一年使用:0次
名校
3 . 电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度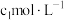 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用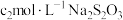 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: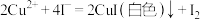 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。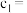
___________ (用 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
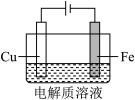 | ① | 0.1mol/L +少量 +少量 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度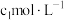 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用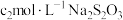 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: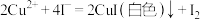 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为
 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近一年使用:0次
2023-07-13更新
|
157次组卷
|
2卷引用:广东省四校(华附,省实,广雅,深中)2022-2023学年高二下学期期末联考化学试题
4 . I.化学电源在生产生活中有着广泛的应用,请回答下列问题。
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能够设计原电池的是_______
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是:_______

II.以氨气替代氢气研发氨燃料电池是当前科研的一个热点。
(3)氨燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:4NH3 + 3O2 = 2N2 + 6H2O,该电池负极的电极反应为:_______
(4)以上述氨燃料电池接下图A.B两极(C、D、E、F都是惰性电极)。电源接通后,F极附近溶液呈红色,请回答:甲池中电极C名称为:_______ ,乙池中发生的离子反应方程式为:_______ ,丙装置是验证外加电流法对钢铁设备的保护(电解液为盐酸酸化的氯化钠溶液),钢铁应该接在_______ 处(填G或H)。为证明铁被保护,可先取少量的电解后的溶液于试管中,向溶液中加入_______ 溶液观察颜色变化。

(1)根据构成原电池的本质判断,下列化学反应方程式正确且能够设计原电池的是_______
| A.KOH + HCl =KCl + H2O | B.Cu + FeCl3 = FeCl2 + CuCl2 |
| C.Na2O + H2O = 2NaOH | D.Fe+ H2SO4=FeSO4 +H2↑ |

| A.图I中温度计的示数高于图II的示数 |
| B.图I和图II中温度计的示数相等,且均高于室温 |
| C.图I和图II中的气泡均产生于锌棒表面 |
| D.图II中产生气体的速率比I慢 |
II.以氨气替代氢气研发氨燃料电池是当前科研的一个热点。
(3)氨燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:4NH3 + 3O2 = 2N2 + 6H2O,该电池负极的电极反应为:
(4)以上述氨燃料电池接下图A.B两极(C、D、E、F都是惰性电极)。电源接通后,F极附近溶液呈红色,请回答:甲池中电极C名称为:

您最近一年使用:0次
2022-09-13更新
|
371次组卷
|
2卷引用:广东省广州市番禺区2021-2022学年高二上学期期末考试化学试题
解题方法
5 . 甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+ O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g) C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=________ kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用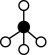 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________ (填字母)。

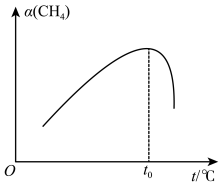
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是_______ 。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
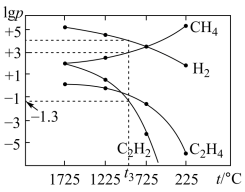
①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________ 。(保留3位有效数字)若改变温度至t2℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________ t2(填“>”“=”或“<”)。
②在图中,t3℃时,化学反应2CH4(g) C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=____ 。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________ 。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
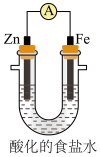
得出结论:①锌______ 保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+
 O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)
 C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用
 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是

(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:

①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为②在图中,t3℃时,化学反应2CH4(g)
 C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为
(5)设计如图实验探究牺牲阳极的阴极保护法原理:

| 操作 | 现象 |
| (i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
| (ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成
您最近一年使用:0次
名校
解题方法
6 . 高纯镓是制备第三代半导体的重要原料,其化学性质与铝相似。下图为工业精炼镓的装置示意图。下列说法不正确的是

A.阴极的电极反应为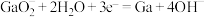 |
B.电解过程中,阳极室中 的物质的量减小 的物质的量减小 |
C.电路中每转移 电子,理论上粗镓熔融液减少 电子,理论上粗镓熔融液减少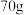 |
D.电解后粗镓中的 以离子形式进入 以离子形式进入 溶液中 溶液中 |
您最近一年使用:0次
2024-03-01更新
|
679次组卷
|
5卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)吉林省长春市东北师范大学附属中学2024届高三下学期第五次模拟考试化学试题河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题黑龙江省哈尔滨工业大学附属中学校2024届高三下学期五模化学试题
名校
解题方法
7 . 某小组采用电化学法制备有机物,装置如图所示。双极膜是由阴膜和阳膜组成的,双极膜中水电离出的阴、阳离子在电场中向两极迁移。下列叙述正确的是

| A.a极与电源负极连接 |
B.制备1mol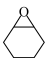 时双极膜内质量减少18g 时双极膜内质量减少18g |
C.b极的电极反应式为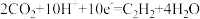 |
D.每转移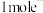 ,生成 ,生成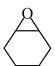 、 、 的物质的量之比为1:5 的物质的量之比为1:5 |
您最近一年使用:0次
2024-02-02更新
|
425次组卷
|
4卷引用:广东省湛江市2023-2024学年高三上学期1月期末化学试题
广东省湛江市2023-2024学年高三上学期1月期末化学试题福建省厦门第一中学2023-2024学年高三下学期2月第一次月考化学试卷(已下线)化学(天津卷03)-2024年高考化学押题预测卷河南省TOP二十名校2024届高三下学期5月冲刺(一)理综试卷-高中化学
名校
解题方法
8 . 利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是
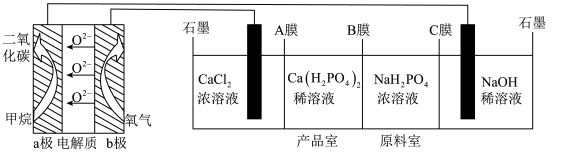
| A.a极反应:CH4-8e﹣+4O2﹣=CO2+2H2O |
| B.A、C膜均为阳离子交换膜,B膜为阴离子交换膜 |
| C.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.2mol |
| D.阳极室有氯气产生,阴极室中有氢气产生且NaOH浓度增大 |
您最近一年使用:0次
名校
9 . 电化学方法是化工生产中常用的一种方法。利用该装置可以得到不同的产物:
(1)b电极的电极反应式:___________
(2)该电解池的总方程式:___________
(3)若有产生0.4mol电子,产生气体的总体积是___________ (标准状况下)
Ⅱ.二氧化氯(ClO2)是一种高效、广谱、快速、安全的杀菌消毒剂。用石墨作电极,在一定条件下电解饱和食盐水制取ClO2工艺。
(4)a电极附近pH___________ (填“增大”“减小”或“不变”)。电极反应式为___________ 。
(5)b电极作电解池的___________ 极,电极反应式为___________ 。
(6)该工艺应使用___________ (填“阴”或“阳”)离子交换膜。

(1)b电极的电极反应式:
(2)该电解池的总方程式:
(3)若有产生0.4mol电子,产生气体的总体积是
Ⅱ.二氧化氯(ClO2)是一种高效、广谱、快速、安全的杀菌消毒剂。用石墨作电极,在一定条件下电解饱和食盐水制取ClO2工艺。
(4)a电极附近pH
(5)b电极作电解池的
(6)该工艺应使用
您最近一年使用:0次
10 . 纳米 具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁
具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁 ,含少量
,含少量 等杂质]制备纳米
等杂质]制备纳米 的工艺流程,整个过程中钛的化合价没有变化。
的工艺流程,整个过程中钛的化合价没有变化。
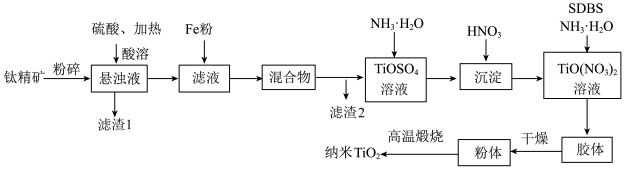
已知:① 易溶于水,溶液无色透明;
易溶于水,溶液无色透明;
②SDBS(十二烷基苯磺酸钠)是表面活性剂,它能包覆在晶粒表面形成胶体,防止形成较大颗粒。
(1)滤液中钛以 的形式存在,则酸溶时
的形式存在,则酸溶时 与硫酸发生反应的化学方程式为
与硫酸发生反应的化学方程式为________________ ;向滤液中加入Fe粉的作用是________________ 。
(2)向 溶液中加入
溶液中加入 调节溶液的pH,当pH大于2时
调节溶液的pH,当pH大于2时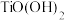 沉淀完全,该反应的离子方程式为
沉淀完全,该反应的离子方程式为________________ ;验证沉淀充分洗涤干净的方法为________________ 。
(3)如图为不同条件下形成的二氧化钛晶粒的尺寸与外界条件的变化关系图。

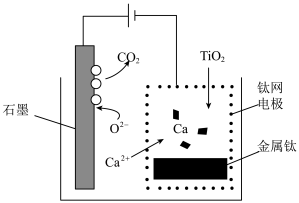
为了获得15nm-20nm左右的二氧化钛晶体,选用SDBS质量分数为________ ,选用pH范围为________ 。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融的 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为________________ 。
 具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁
具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁 ,含少量
,含少量 等杂质]制备纳米
等杂质]制备纳米 的工艺流程,整个过程中钛的化合价没有变化。
的工艺流程,整个过程中钛的化合价没有变化。
已知:①
 易溶于水,溶液无色透明;
易溶于水,溶液无色透明;②SDBS(十二烷基苯磺酸钠)是表面活性剂,它能包覆在晶粒表面形成胶体,防止形成较大颗粒。
(1)滤液中钛以
 的形式存在,则酸溶时
的形式存在,则酸溶时 与硫酸发生反应的化学方程式为
与硫酸发生反应的化学方程式为(2)向
 溶液中加入
溶液中加入 调节溶液的pH,当pH大于2时
调节溶液的pH,当pH大于2时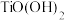 沉淀完全,该反应的离子方程式为
沉淀完全,该反应的离子方程式为(3)如图为不同条件下形成的二氧化钛晶粒的尺寸与外界条件的变化关系图。

为了获得15nm-20nm左右的二氧化钛晶体,选用SDBS质量分数为
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融的
 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
您最近一年使用:0次



