真题
名校
1 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: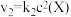 和
和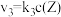 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: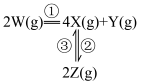
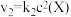 和
和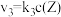 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
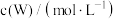 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.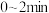 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若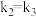 ,平衡时 ,平衡时 |
D.若升高温度,平衡时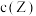 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
2968次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题
2 . 向饱和氯水中加入少量 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是
 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是| A.溶液pH减小 | B.溶液颜色变深 | C.漂白性增强 | D.导电性减弱 |
您最近一年使用:0次
真题
名校
3 . 某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入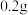 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知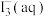 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入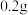 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知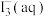 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |  在水中溶解度较小 在水中溶解度较小 |
| B | 溶液颜色加深 | 发生了反应: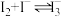 |
| C | 紫黑色晶体消失 |  ( ( )的消耗使溶解平衡 )的消耗使溶解平衡 右移 右移 |
| D | 溶液褪色 |  与有色物质发生了置换反应 与有色物质发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-13更新
|
7976次组卷
|
17卷引用:福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题
福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题2023年高考辽宁卷化学真题(已下线)T13-实验方案的设计与评价(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷(已下线)第3讲 物质制备实验的设计与评价10-2023新东方高二上期中考化学中国人民大学附属中学2023-2024学年高三下学期化学练习6湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题(已下线)FHgkyldyjhx10
名校
4 . 已知:
 ,一定条件下CO与H2O(g)反应的v-t图像如下。30min、40min时分别只改变一个条件。下列说法错误的是
,一定条件下CO与H2O(g)反应的v-t图像如下。30min、40min时分别只改变一个条件。下列说法错误的是

 ,一定条件下CO与H2O(g)反应的v-t图像如下。30min、40min时分别只改变一个条件。下列说法错误的是
,一定条件下CO与H2O(g)反应的v-t图像如下。30min、40min时分别只改变一个条件。下列说法错误的是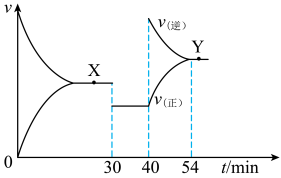
| A.30min时,降低体系压强 |
B.40min时,增加 或 或 的浓度 的浓度 |
C.平衡常数: |
D.CO转化率: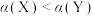 |
您最近一年使用:0次
2023-02-22更新
|
482次组卷
|
5卷引用:福建省泉州市2022-2023学年高二上学期质量监测化学试题
名校
解题方法
5 . 硫酸锌是一种重要的工业原料,ZnSO4∙H2O可用于制造印染用的媒染剂,木材及皮革保存剂等。以炼锌厂锌渣为原料,含ZnO、FeO、CuO、CdO等,生产ZnSO4∙H2O的流程如下:
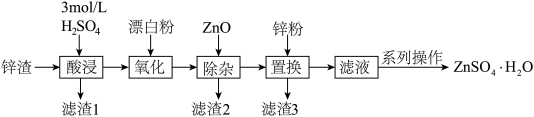
已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
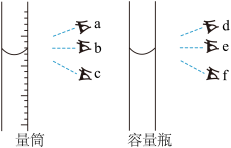
(1)“酸浸”时,需不断通入高温水蒸气,其目的是___________ (填字母)。用18 mol∙L-1的浓硫酸配制3 mol∙L-1H2SO4溶液,下列操作会使所配溶液浓度偏小的是___________ (填字母)。
(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:___________ 。除杂过程中,若控制pH=4,溶液中c(Fe3+)=___________ mol∙L-1。结合实际生产情况一般取pH4.5~5.0,pH不宜过大的原因是___________ 。
(3)滤渣3含有Zn和___________ (写化学式)。
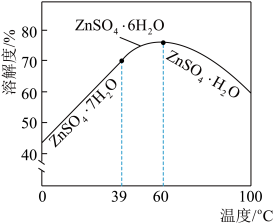
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:___________ ,洗涤、干燥。

已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是

(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:
(3)滤渣3含有Zn和
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:

您最近一年使用:0次
2023-01-08更新
|
285次组卷
|
3卷引用:福建省宁德市2022-2023学年高二上学期期末居家检测化学试题
福建省宁德市2022-2023学年高二上学期期末居家检测化学试题山西省名校联考2022-2023学年高二上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
解题方法
6 . 下列现象不能用平衡移动原理解释的是
A.为了准确测定 的相对分子质量,应尽量在高温低压条件下测定 的相对分子质量,应尽量在高温低压条件下测定 |
| B.实验室制备乙酸乙酯,加入浓硫酸作为吸水剂 |
| C.实验室制备氯气,选用饱和食盐水净化氯气 |
D. 与稀硫酸反应,加入适量硫酸铜晶体可以加快氢气的生成速率 与稀硫酸反应,加入适量硫酸铜晶体可以加快氢气的生成速率 |
您最近一年使用:0次
2022-11-11更新
|
214次组卷
|
5卷引用:福建省宁德第一中学2023-2024学年高二上学期10月月考化学试题
名校
7 . 下列说法不符合勒夏特列原理的是
A.反应A2(g) + B2(g) 2AB(g),平衡后压缩容器,AB浓度增大 2AB(g),平衡后压缩容器,AB浓度增大 |
| B.密封保存碳酸饮料以防止CO2释放 |
| C.用饱和食盐水净化氯气以减少氯气溶于水 |
| D.酯化反应中增加醇的用量以提高酸的转化率 |
您最近一年使用:0次
2022-11-02更新
|
458次组卷
|
6卷引用:福建省莆田第一中学2022-2023学年高二上学期期末考试化学试题
名校
8 . 已知: 的反应历程分两步:
的反应历程分两步:
第1步: (快)
(快) 
第2步: (慢)
(慢) 
在固定容积的容器中充入一定量NO和 发生上述反应,测得体系中部分物质的物质的量(n)随温度(T)的变化如图所示。下列说法错误的是
发生上述反应,测得体系中部分物质的物质的量(n)随温度(T)的变化如图所示。下列说法错误的是

 的反应历程分两步:
的反应历程分两步:第1步:
 (快)
(快) 
第2步:
 (慢)
(慢) 
在固定容积的容器中充入一定量NO和
 发生上述反应,测得体系中部分物质的物质的量(n)随温度(T)的变化如图所示。下列说法错误的是
发生上述反应,测得体系中部分物质的物质的量(n)随温度(T)的变化如图所示。下列说法错误的是
A.第1步、第2步正反应活化能分别为 、 、 ,则 ,则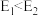 |
B.a点后, 迅速减小的原因是第1步平衡逆向移动,第2步速率加快 迅速减小的原因是第1步平衡逆向移动,第2步速率加快 |
C.b点后, 增加的原因是第2步平衡逆向移动的程度比第1步的大 增加的原因是第2步平衡逆向移动的程度比第1步的大 |
| D.若其他条件不变,仅将容器变为恒压状态,则体系建立平衡的时间不变 |
您最近一年使用:0次
2022-06-02更新
|
1245次组卷
|
11卷引用:福建省厦门双十学校2022-2023学年高二上学期期中考化学试卷
福建省厦门双十学校2022-2023学年高二上学期期中考化学试卷重庆市第一中学校2022届高三考前适应性考试化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)湖南省株洲市天元区名校2022-2023学年高二上学期12月月考化学试题辽宁省部分学校2022-2023学年高三下学期三模化学试题 (已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)辽宁省辽东南协作校2023届高三下学期第三次模拟考试化学试题云南省临沧市第一中学2022-2023学年高二上学期期中考试化学试题
9 . 三元锂电池的正极材料中可含有大量的金属锂元素(LiCo1-x-yMnxNiyO2),还含有铝箔、碳和有机粘结剂等杂质。用废旧正极材料回收镍、钴、锰等金属的流程如图所示。
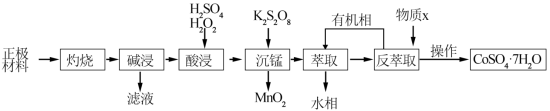
(1)灼烧的目的是_______ 。
(2)酸浸后,Ni、Co、Mn元素均以+2价形式存在。酸浸时含Co物质(以LiCoO2表示)发生反应的化学方程式为_______ 。
(3)沉锰时,需先加入适量K2S2O8,将部分Mn2+氧化成 ,沉锰时生成MnO2的离子方程式为
,沉锰时生成MnO2的离子方程式为_______ 。
(4)萃取和反萃取的过程表示为:Co2++2(HA)2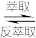 Co(HA2)2+2H+,反萃取时加入的物质X为
Co(HA2)2+2H+,反萃取时加入的物质X为_______ (填化学式),请从化学平衡的角度说明所加物质的作用_______ 。
(5)从水相回收镍时,需往混合溶液中加入氢氧化钠,以获取Ni(OH)2。常温下,为使Ni2+完全沉淀,溶液的pH至少应大于_______ (当c(Ni2+)<10-5mol/L时,视为沉淀完全,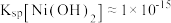 )
)
(6)CoSO4·7H2O受热时,剩余固体的物质的质量随温度变化情况如图所示,物质B的化学式为_______ 。


(1)灼烧的目的是
(2)酸浸后,Ni、Co、Mn元素均以+2价形式存在。酸浸时含Co物质(以LiCoO2表示)发生反应的化学方程式为
(3)沉锰时,需先加入适量K2S2O8,将部分Mn2+氧化成
 ,沉锰时生成MnO2的离子方程式为
,沉锰时生成MnO2的离子方程式为(4)萃取和反萃取的过程表示为:Co2++2(HA)2
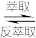 Co(HA2)2+2H+,反萃取时加入的物质X为
Co(HA2)2+2H+,反萃取时加入的物质X为(5)从水相回收镍时,需往混合溶液中加入氢氧化钠,以获取Ni(OH)2。常温下,为使Ni2+完全沉淀,溶液的pH至少应大于
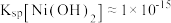 )
)(6)CoSO4·7H2O受热时,剩余固体的物质的质量随温度变化情况如图所示,物质B的化学式为

您最近一年使用:0次
10 . 下列有关事实和解释均正确的是
| 选项 | 事实 | 解释 |
| A | 分别向K3[Fe(CN)6]溶液和Fe(SCN)3溶液中滴加等浓度的氢氧化钠溶液,只有Fe(SCN)3溶液中有黄色沉淀生成 | CN-对Fe3+的配位能力比SCN-更强,溶液中没有Fe3+ |
| B | 向碘的四氯化碳溶液中加入适量浓KI溶液,振荡试管,溶液紫色变浅 | c(I-)增大,I2+I- I I 平衡向右移动 平衡向右移动 |
| C | 向酸式滴定管中加入蒸馏水,打开活塞让水缓缓流下,可看到水呈直线状垂直流入烧杯中。若用头发摩擦过的气球靠近,水流会向一侧偏转 | 水分子中含有极性键,会受到带电物体的吸引 |
| D | 向盛有AgCl沉淀的试管中滴入足量1mol/L氨水,振荡,溶液变澄清 | AgCl+2NH3=[Ag(NH3)2]Cl,NH3的N接受电子对 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-20更新
|
119次组卷
|
2卷引用:福建省莆田锦江中学2022-2023学年高二下学期期中考试化学试题



