1 . 化学与生活息息相关。下列叙述正确的是
| A.土豆中的淀粉经水解可变成酒 | B.鲜榨橙汁遇到碘水会变蓝 |
| C.蛋白质经水解可变成葡萄糖 | D.馒头越嚼越甜 |
您最近一年使用:0次
名校
解题方法
2 . 某小组利用下图装置探究 的性质。下列关于实验现象的解释中,
的性质。下列关于实验现象的解释中,不正确 的是
 的性质。下列关于实验现象的解释中,
的性质。下列关于实验现象的解释中,
A.通入 前,①中溶液显红色的原因: 前,①中溶液显红色的原因: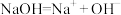 |
B.通入 后,①中溶液颜色褪去的原因: 后,①中溶液颜色褪去的原因: 具有漂白性 具有漂白性 |
C.通入 前,②中溶液显蓝色的原因:淀粉遇碘单质变蓝 前,②中溶液显蓝色的原因:淀粉遇碘单质变蓝 |
D.通入 后,②中溶液颜色褪去的原因: 后,②中溶液颜色褪去的原因: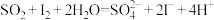 |
您最近一年使用:0次
2023-01-06更新
|
261次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高一下学期期中考试化学试题
3 . 直链淀粉是由α-葡萄糖分子缩合而形成直径为1.3 nm螺旋状的长长的螺旋体,借助葡萄糖单元上的羟基,每6个葡萄糖单元与1个碘分子配合,碘分子处在螺旋的轴心部位,形成淀粉-碘螺旋形包合物(如图)。下列推测不正确 的是
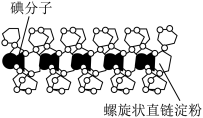

| A.直链淀粉分子形成螺旋体可能与淀粉分子内的氢键有关 |
| B.碘分子通过与淀粉分子之间的氢键形成淀粉-碘螺旋形包合物 |
| C.适当升高温度,淀粉-碘螺旋体构象受到破坏,引起淀粉-碘溶液颜色变浅 |
| D.一定条件下,淀粉-碘螺旋形包合物可形成分子晶体 |
您最近一年使用:0次
2022-12-13更新
|
144次组卷
|
2卷引用:山东省青岛市莱西市2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
4 . I.氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为CO2和N2,该反应的离子方程式为____ 。
II.工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
【实验一】实验室通过如图所示装置制备硫代硫酸钠。
关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。

(2)①装置A中盛放浓硫酸的仪器名称是____ ;②装置B的作用是____ ;③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有____ 。
(3)实验结束后,在E处可连接盛有____ (填序号)溶液的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3•5H2O,一般可用I2的标准溶液测定产品纯度原理为:2Na2S2O3+I2= Na2S4O6+2NaI。
(4)上述滴定操作中应该选用____ 作为反应的指示剂。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为CO2和N2,该反应的离子方程式为
II.工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
【实验一】实验室通过如图所示装置制备硫代硫酸钠。
关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。

(2)①装置A中盛放浓硫酸的仪器名称是
(3)实验结束后,在E处可连接盛有
| A.BaCl2溶液 | B.浓硫酸 | C.酸性KMnO4溶液 | D.NaOH溶液 |
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3•5H2O,一般可用I2的标准溶液测定产品纯度原理为:2Na2S2O3+I2= Na2S4O6+2NaI。
(4)上述滴定操作中应该选用
您最近一年使用:0次
5 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向淀粉溶液中加适量 溶液,加热,冷却后加 溶液,加热,冷却后加 溶液至中性,再滴加少量碘水,溶液变蓝 溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
| B | 向苯和液溴的混合液中加入铁粉,将产生的气体通入 溶液,产生淡黄色沉淀 溶液,产生淡黄色沉淀 | 苯与溴发生了取代反应成了 |
| C | 某卤代烃与氢氧化钠溶液混合加热,冷却后滴加 溶液,未出现淡黄色沉淀 溶液,未出现淡黄色沉淀 | 该卤代烃中不含有溴元素 |
| D | 将锌片和铁片用导线相连后放入经过酸化的 溶液中(两极间保持一定距离),一段时间后往铁电极区滴入2滴 溶液中(两极间保持一定距离),一段时间后往铁电极区滴入2滴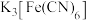 (铁氰化钾,遇 (铁氰化钾,遇 会生成蓝色沉淀)溶液,铁片附近溶液无蓝色沉淀生成 会生成蓝色沉淀)溶液,铁片附近溶液无蓝色沉淀生成 | 牺牲阳极的阴极保护法 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验淀粉是否已经发生水解 | 将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH)2,加热,没有砖红色沉淀产生 | 淀粉未发生水解 |
| B | 探究KI与FeCl3反应的限度 | 取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液 | 若有白色沉淀产生, 则样品已经变质 |
| D | 检验气体Y | 用湿润的淀粉碘化钾试纸检验气体Y, | 试纸变蓝色,Y一定是Cl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-19更新
|
353次组卷
|
3卷引用:浙江省S9联盟2021-2022学年高二上学期期中联考化学试题
名校
解题方法
7 . ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
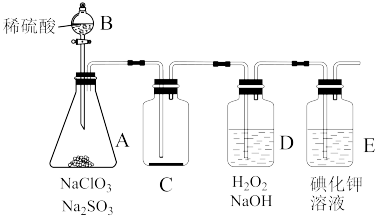
(1)仪器的B名称是___________ 。
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为___________ ;D中吸收ClO2后生成NaClO2,写出D中所发生反应的离子方程式:___________ 。
(3)E中溶液出现黄色___________ (填“能”或“否”)说明ClO2未被 和NaOH的混合溶液充分吸收,说明理由:
和NaOH的混合溶液充分吸收,说明理由:___________ 。
(4)已知:当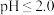 时,ClO
时,ClO 能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO
能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO 。请补充完整检验E装置溶液中存在少量ClO
。请补充完整检验E装置溶液中存在少量ClO 的实验方案:取一定体积E装置中的溶液于分液漏斗中,
的实验方案:取一定体积E装置中的溶液于分液漏斗中,___________ ,则溶液中存在ClO 。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)

(1)仪器的B名称是
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为
(3)E中溶液出现黄色
 和NaOH的混合溶液充分吸收,说明理由:
和NaOH的混合溶液充分吸收,说明理由:(4)已知:当
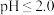 时,ClO
时,ClO 能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO
能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO 。请补充完整检验E装置溶液中存在少量ClO
。请补充完整检验E装置溶液中存在少量ClO 的实验方案:取一定体积E装置中的溶液于分液漏斗中,
的实验方案:取一定体积E装置中的溶液于分液漏斗中, 。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
您最近一年使用:0次
名校
8 . 下列物质应用正确的是
| A.泡沫灭火器可用于金属钠着火时灭火 | B.碳酸钡可用于胃肠X射线造影检查 |
| C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | D.用淀粉检验食盐中的碘元素 |
您最近一年使用:0次
2021-11-05更新
|
332次组卷
|
4卷引用:河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三上学期期中考试化学试题
河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三上学期期中考试化学试题河北省石家庄2021-2022学年高三上学期期中考试化学试题(已下线)基础卷01-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)天津市耀华中学2021-2022学年高三上学期第三次月考化学试题
9 . NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
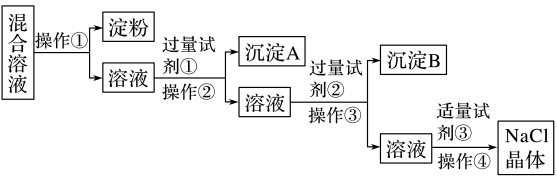
(1)写出上述实验过程中所用试剂(写化学式):试剂①_______ ;试剂③_______ 。
(2)判断试剂①已过量的方法是_______ 。
(3)用离子方程式表示加入试剂②的作用:_______ 。
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉_______ (填“能”或“不能”)透过半透膜;SO
_______ (填“能”或“不能”)透过半透膜。请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:1 mol·L-1 AgNO3溶液、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸

(1)写出上述实验过程中所用试剂(写化学式):试剂①
(2)判断试剂①已过量的方法是
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉

| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
您最近一年使用:0次
2021-10-18更新
|
383次组卷
|
6卷引用:2015-2016学年安徽师大附属中学高一上期中测试化学试卷
2015-2016学年安徽师大附属中学高一上期中测试化学试卷2016-2017学年广西陆川中学高一上期中化学卷【全国百强校】广东省佛山市第一中学2018-2019学年高一上学期第一次段考化学试题人教版(2019)高一必修第一册 第一章 物质及其变化 第二节 离子反应(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省齐齐哈尔市龙江县第一中学2021-2022学年高一9月月考化学试题
名校
10 . 某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告:
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂_______ (填名称),KI溶液,浓度为0.010 mol·L-1的标准Na2S2O3溶液,蒸馏水等。
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视_______ 直至滴定终点,滴定至终点的现象是_______ 。
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为_______ ,从实验过程分析,此浓度比实际浓度_______ (填“偏大”、“偏小”或“相等”),造成误差的原因是_______ (若认为没有误差,该问可不答)。
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是_______ (填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
| 滴定次数 | |||||
| 平均值 | |||||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
您最近一年使用:0次



