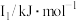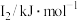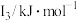1 . 物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第三周期元素I1变化规律如图所示,第三周期元素中I1处于Al与P之间的元素符号是___________ 。___________ 。
(3)已知固态HF、H2O、NH3的氢键键能和结构如下:
___________ 个水分子包围形成___________ 构型。
(4)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________ 个。
(1)第三周期元素I1变化规律如图所示,第三周期元素中I1处于Al与P之间的元素符号是

(3)已知固态HF、H2O、NH3的氢键键能和结构如下:
| 物质 | 氢键X-H···Y | 氢键键能kJ·mol-1 |
| (HF)n | F-H···F | 28.1 |
| 冰 | O-H···O | 18.8 |
| (NH3)n | N-H···N | 5.4 |

(4)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有

您最近一年使用:0次
解题方法
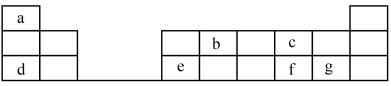
2 . 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。______ (金属或非金属)元素;元素b在元素周期表中的位置为______ 。
(2)元素c的原子结构示意图_______ ;元素f的元素符号为______ ;元素c和f的原子半径大小关系为c____ f(>或<)
(3)元素d和元素g形成的盐的电子式为_______ 。
(4)第一电离能a___ d(>或<),非金属性c___ f(>或<)。
(2)元素c的原子结构示意图
(3)元素d和元素g形成的盐的电子式为
(4)第一电离能a
您最近一年使用:0次
3 . 按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的电子排布式是______ ,基态Cl原子未成对电子数为_____ 个。
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为_______ (填元素符号),氧元素和氮元素的非金属性的大小顺序为________ (填元素符号)
(3)某元素原子的最外层电子构型为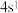 ,元素周期表的位置第
,元素周期表的位置第____ 周期,第_____ 族,它属于____ 区元素。
(1)消毒液的组成元素中,基态O原子的电子排布式是
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为
(3)某元素原子的最外层电子构型为
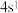 ,元素周期表的位置第
,元素周期表的位置第
您最近一年使用:0次
4 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近一年使用:0次
解题方法
5 . 周期表中25号锰元素及其化合物在生产、生活中有广泛应用。
(1)基态Mn原子核外共有________ 种能量不同的电子。
(2)利用 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中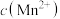 和
和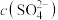 随反应时间的变化如图1所示。导致溶液中
随反应时间的变化如图1所示。导致溶液中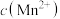 和
和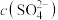 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:________ 。
①阴极产生气体,其电极反应式为________ 。
② 与煤中的含硫物质(主要是
与煤中的含硫物质(主要是 )反应的离子方程式是
)反应的离子方程式是________ 。
③电解过程中,当有 被氧化时,混合溶液中
被氧化时,混合溶液中 的物质的量将增大
的物质的量将增大________ mol(不考虑溶液中水的体积变化)。
(1)基态Mn原子核外共有
(2)利用
 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中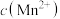 和
和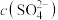 随反应时间的变化如图1所示。导致溶液中
随反应时间的变化如图1所示。导致溶液中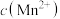 和
和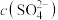 的变化产生明显差异的原因是:
的变化产生明显差异的原因是: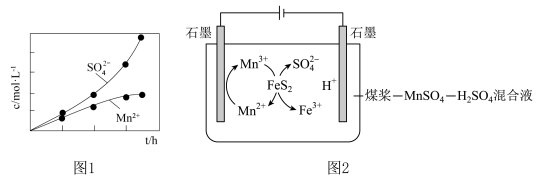
①阴极产生气体,其电极反应式为
②
 与煤中的含硫物质(主要是
与煤中的含硫物质(主要是 )反应的离子方程式是
)反应的离子方程式是③电解过程中,当有
 被氧化时,混合溶液中
被氧化时,混合溶液中 的物质的量将增大
的物质的量将增大
您最近一年使用:0次
6 . 按要求回答下列问题:
(1)酸溶于水可形成 ,
, 的电子式为
的电子式为________ 。判断 和
和 的键角大小:
的键角大小:
________  (填“>”或“<”)。
(填“>”或“<”)。
(2)氨硼烷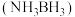 是一种特殊的化合物,分子中与N原子相连的H呈正电性
是一种特殊的化合物,分子中与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。则氨硼烷分子中元素电负性由小到大的顺序为
。则氨硼烷分子中元素电负性由小到大的顺序为________ (填元素符号)
(3)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是________ 。
(4)丁二酮肟(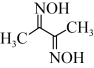 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定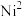 的存在。
的存在。
①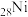 的价电子轨道表示式为
的价电子轨道表示式为________ 。
②丁二酮肟分子中 键和
键和 键数目的比例为
键数目的比例为________ 。
(5)在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是________ 。
(1)酸溶于水可形成
 ,
, 的电子式为
的电子式为 和
和 的键角大小:
的键角大小:
 (填“>”或“<”)。
(填“>”或“<”)。(2)氨硼烷
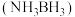 是一种特殊的化合物,分子中与N原子相连的H呈正电性
是一种特殊的化合物,分子中与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。则氨硼烷分子中元素电负性由小到大的顺序为
。则氨硼烷分子中元素电负性由小到大的顺序为(3)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是
元素 |
|
|
|
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
(4)丁二酮肟(
 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定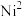 的存在。
的存在。①
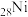 的价电子轨道表示式为
的价电子轨道表示式为②丁二酮肟分子中
 键和
键和 键数目的比例为
键数目的比例为(5)在空气中FeO稳定性小于
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是
您最近一年使用:0次
7 . 按要求回答下列问题:
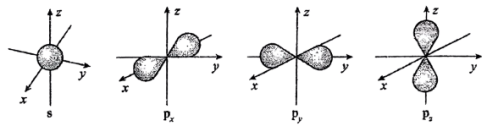
(1)如图是s能级和p能级的电子云轮廓图,试回答问题。______ 形,每个p能级有______ 个原子轨道。
(2)按要求作答:
①画出氯原子结构示意图______ ;
②写出基态O核外电子排布式为:______ ;
③写出基态N的原子轨道表示式:______ ;
(3)Sm的价层电子排布式为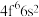 ,则
,则 价层电子排布式为
价层电子排布式为______ 。
(1)如图是s能级和p能级的电子云轮廓图,试回答问题。
(2)按要求作答:
①画出氯原子结构示意图
②写出基态O核外电子排布式为:
③写出基态N的原子轨道表示式:
(3)Sm的价层电子排布式为
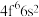 ,则
,则 价层电子排布式为
价层电子排布式为
您最近一年使用:0次
解题方法
8 . 请按要求回答以下问题:
(1)基态F原子的核外电子轨道表达式为___________ 。
(2)25Mn原子核外电子排布式为___________ 。
(3)菱锌矿ZnCO3中基态30Zn原子价电子排布式___________ ,基态C原子的核外电子占据的最高能级电子云轮廓为___________ ,基态O原子有___________ 种运动状态不同的电子。
(4)常温下,0.1mol·L-1NaHCO3溶液中,c( )<c(H2CO3),则溶液显
)<c(H2CO3),则溶液显___________ 性。
(1)基态F原子的核外电子轨道表达式为
(2)25Mn原子核外电子排布式为
(3)菱锌矿ZnCO3中基态30Zn原子价电子排布式
(4)常温下,0.1mol·L-1NaHCO3溶液中,c(
 )<c(H2CO3),则溶液显
)<c(H2CO3),则溶液显
您最近一年使用:0次
解题方法
9 . 请填空:
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为______ ;B元素M能层p电子数为s电子数的一半,B的元素名称为______ 。
(2)下图是s能级和p能级的原子轨道图。____ 形,每个s能级有____ 个原子轨道;p电子的原子轨道呈____ 形,每个p能级有____ 个原子轨道。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为____ ,其基态原子的核外电子排布式为______ 。
(4)常温下,向100 mL 0.01 mol⋅L HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。_____ (填“强”或“弱”)酸。常温下一定浓度的MA稀溶液的 ,则a
,则a_____ (填“>”“<”或“=”)7,用离子方程式表示其原因:______ 。
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为
(2)下图是s能级和p能级的原子轨道图。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为
(4)常温下,向100 mL 0.01 mol⋅L
 HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。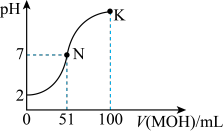
 ,则a
,则a
您最近一年使用:0次
10 . 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素原子次外层电子数是最外层电子数的 ,其最外层电子的轨道表示式为
,其最外层电子的轨道表示式为___________ 。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是___________ ,在元素周期表中的位置是___________ 。
(3)C元素基态原子的轨道表示式是下图中的___________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合___________ (填序号)。
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量称为第一电离能(设为E)。如图所示:___________ 。
②根据图中提供的信息,可推断出E(氧)___________ (填“>”“<”或“=”,下同)E(氟)。
③根据第一电离能的含义和元素周期律可推断出E(镁)___________ E(钙)。
(1)A元素原子次外层电子数是最外层电子数的
 ,其最外层电子的轨道表示式为
,其最外层电子的轨道表示式为(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是
(3)C元素基态原子的轨道表示式是下图中的
①
②
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量称为第一电离能(设为E)。如图所示:
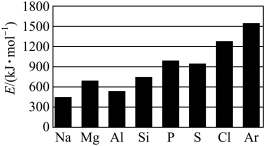
②根据图中提供的信息,可推断出E(氧)
③根据第一电离能的含义和元素周期律可推断出E(镁)
您最近一年使用:0次