1 . 缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物,某科学小组依据 、
、 、
、 分子对此进行研究。
分子对此进行研究。
(1)写出B原子的价层电子轨道表示式_______ 。
(2) 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是_______ ,其_______ (能/不能)提供孤对电子与Fe2+形成配位键。
(3)上述三种化合物中,是缺电子化合物的是_______ 。
(4)NH3分子极易溶于水,是说明理由_______ 。
 、
、 、
、 分子对此进行研究。
分子对此进行研究。(1)写出B原子的价层电子轨道表示式
(2)
 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是(3)上述三种化合物中,是缺电子化合物的是
(4)NH3分子极易溶于水,是说明理由
您最近一年使用:0次
2 . 按要求回答问题。
(1)1 mol HCHO分子中含有σ键的数目为___________ NA。
(2)CS2分子中,共价键的类型有___________ 。
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是___________ (填序号,下同),只存在非极性键的是___________ ,只存在离子键的是___________ ,既存在离子键又存在极性共价键的是___________ ,既存在离子键又存在非极性共价键的是___________ 。
(4)第一电离能比较Mg___________ Al,解释原因___________ 。
(1)1 mol HCHO分子中含有σ键的数目为
(2)CS2分子中,共价键的类型有
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是
(4)第一电离能比较Mg
您最近一年使用:0次
解题方法
3 . 高氯酸三碳酰肼合镍化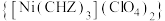 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态铜原子的价电子的轨道表示式为________ 。
(2)基态碳原子核外电子有________ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为________ , 的VSEPR模型是
的VSEPR模型是________ 。
(4)化学式中的CHZ为碳酰肼,其结构为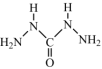 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为________ 。
②1molCHZ中含有的 键数目为
键数目为________  。
。
③键角:
________ (填“>”“<”或“=”) 。
。
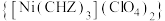 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态铜原子的价电子的轨道表示式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的
 键数目为
键数目为 。
。③键角:

 。
。
您最近一年使用:0次
4 . 磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂电池的正极材料。回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是___________ (填元素符号)。基态O原子的价电子排布图为___________ 。基态P原子电子占据最高能级的电子云在空间有___________ 个伸展方向。
(2)写出H2O2的电子式___________ 。
(3)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为___________ 。
(4)第三周期元素中,第一电离能介于A1和P之间的元素有___________ 种。
(5)Fe元素位于周期表的___________ 区。已知:I3(Mn)=3248kJ/mol,I3(Fe)=2957kJ/mol。第三电离能I3(Mn)>I3(Fe),其主要原因是___________ 。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)写出H2O2的电子式
(3)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(4)第三周期元素中,第一电离能介于A1和P之间的元素有
(5)Fe元素位于周期表的
您最近一年使用:0次
名校
5 . 在1778年,法国马厚比无意中发现用硫酸钠、木炭和铁(后改用氧化铁)一起灼烧,再用水滗取可得到纯碱。这一发明使他建立起世界上第一座纯碱工厂。
2Fe2O3+3NazSO4+16C Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+O2+2CO2 Na2Fe4S3+2Na2CO3
Na2Fe4S3+2Na2CO3
回答下列问题:
(1)基态铁原子的价层电子排布式为_______ ,其3d能级上有_______ 个运动状态不同的电子。
(2)基态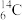 原子核外有
原子核外有_______ 对自旋方向相反的电子对。基态钠原子核外电子占据能量最高的能级符号是_______ 。
(3)在氧、硫、钠、碳、铁元素中,金属性最强的元素与非金属性最强的元素组成的化合物是_______ (填化学式)。C、O、F三种元素中,电负性由大到小的顺序为_______ 。
(4)某同学书写的基态碳原子轨道表示式为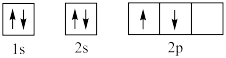 ,他违背了
,他违背了_______ 。
2Fe2O3+3NazSO4+16C
 Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+ 14CO↑+2CO2↑Na6Fe4S3+O2+2CO2
 Na2Fe4S3+2Na2CO3
Na2Fe4S3+2Na2CO3回答下列问题:
(1)基态铁原子的价层电子排布式为
(2)基态
 原子核外有
原子核外有(3)在氧、硫、钠、碳、铁元素中,金属性最强的元素与非金属性最强的元素组成的化合物是
(4)某同学书写的基态碳原子轨道表示式为
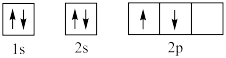 ,他违背了
,他违背了
您最近一年使用:0次
名校
6 . 铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2
[Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为_______ 。H2O中中心原子上的孤电子对数为_______ 。
(2)NH3分子的空间结构为_______ ,其中心原子的杂化类型是_______ 。
(3)CH3COOCH=CH2分子中碳原子的杂化类型是_______ ,1 mol CH3COOCH=CH2中含σ键的数目为_______ 。
(4)相同条件下,CO2与SO2在水中的溶解度较大的是_______ (填分子式), 中的O-C-O键角
中的O-C-O键角_______ (填“>”“<”或“=”)  中的O-S-O键角。
中的O-S-O键角。
 [Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2
[Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。(1)Cu2+基态核外电子排布式为
(2)NH3分子的空间结构为
(3)CH3COOCH=CH2分子中碳原子的杂化类型是
(4)相同条件下,CO2与SO2在水中的溶解度较大的是
 中的O-C-O键角
中的O-C-O键角 中的O-S-O键角。
中的O-S-O键角。
您最近一年使用:0次
解题方法
7 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为___________ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒___________ (分子或离子);
②硫氰酸分子中硫原子的杂化方式为___________ 。
③异硫氰酸的沸点比硫氰酸沸点高的原因是___________ 。
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为___________ pm(列出计算式即可)。

(1)基态铁原子价电子排布式为
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中硫原子的杂化方式为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为

您最近一年使用:0次
8 . 回答下列问题
(1)元素 基态原子的核外电子排布式为
基态原子的核外电子排布式为____________ ;属于____________ 区
(2)基态 原子中,电子占据的最高能层符号为
原子中,电子占据的最高能层符号为____________ ,该能层具有的原子轨道数为____________ .
(3)21号元素为:____________ (填元素符号),属于____________ 族.
(4) 原子序数为
原子序数为____________ ,其核外M层电子的排布式为____________ .
(5)某元素原子的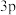 能级上有一个未成对电子,该元素为
能级上有一个未成对电子,该元素为____________ (填元素符号).
(6)第二周期中第一电离能在B和N之间的元素有____________ 种.
(7) 的价电子排布图为
的价电子排布图为____________ .
(1)元素
 基态原子的核外电子排布式为
基态原子的核外电子排布式为(2)基态
 原子中,电子占据的最高能层符号为
原子中,电子占据的最高能层符号为(3)21号元素为:
(4)
 原子序数为
原子序数为(5)某元素原子的
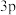 能级上有一个未成对电子,该元素为
能级上有一个未成对电子,该元素为(6)第二周期中第一电离能在B和N之间的元素有
(7)
 的价电子排布图为
的价电子排布图为
您最近一年使用:0次
9 . 按要求回答下列问题:
(1)基态O2-核外电子排布式为_______ 。
(2)基态P原子核外电子排布式为_______ 。
(3)基态Al原子核外电子排布式为_______ 。
(4)基态As原子核外电子简化的轨道表示式为_______ 。
(5)基态Fe3+核外电子简化的轨道表示式为_______ 。
(6)基态Se原子价电子轨道表示式为_______ 。
(1)基态O2-核外电子排布式为
(2)基态P原子核外电子排布式为
(3)基态Al原子核外电子排布式为
(4)基态As原子核外电子简化的轨道表示式为
(5)基态Fe3+核外电子简化的轨道表示式为
(6)基态Se原子价电子轨道表示式为
您最近一年使用:0次
10 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能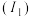 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,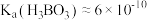 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
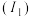 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,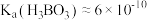 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
129次组卷
|
2卷引用:河南省许平汝名校2023-2024学年高二下学期开学化学试题



