(1)E元素基态原子的简化电子排布式为
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为
(3)元素C的简单气态氢化物的沸点
(4)元素C与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)E元素原子的第一电离能
(7)元素H的原子核外电子有
2 . 根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
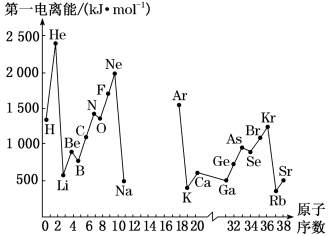
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
 新型化合物材料。回答下列问题:
新型化合物材料。回答下列问题:(1)基态镍原子的外围电子排布式为
(2)在稀氨水介质中,
 与丁二酮肟(分子式为
与丁二酮肟(分子式为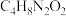 )反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为
)反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为
(3)
 的立体构型为
的立体构型为Ⅱ.叠氮化合物是一类重要的化合物,其中氢叠氮酸(
 )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼(
,肼( )被亚硝酸氧化时便可得到氢叠氮酸(
)被亚硝酸氧化时便可得到氢叠氮酸( ),发生的反应为
),发生的反应为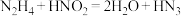 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。试回答下列问题:
。试回答下列问题:(4)下列有关说法正确的是___________(填字母)。
A. 中含有5个 中含有5个 键 键 |
B. 中的三个氮原子均采用 中的三个氮原子均采用 杂化 杂化 |
C. 、 、 、 、 、 、 都是极性分子 都是极性分子 |
D.肼( )的沸点高达113.5℃,说明肼分子间可形成氢键 )的沸点高达113.5℃,说明肼分子间可形成氢键 |
 ,根据价层电子对互斥模型判断
,根据价层电子对互斥模型判断 的空间构型为
的空间构型为| 化合物 | 邻硝基苯酚 | 间硝基苯酚 | 对硝基苯酚 |
| 结构简式 |  |  |  |
| 熔点(℃) | 45 | 96 | 114 |
| A.电负性大小顺序为O>N>C |
| B.三种化合物都是分子晶体 |
| C.对硝基苯酚形成分子间氢键,其熔、沸点较高 |
| D.三种硝基苯酚的化学性质完全相同 |
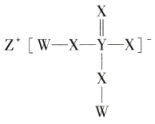
| A.电负性:X>Y>Z |
| B.X、Y分别与W形成的简单化合物的沸点:X>Y |
| C.化合物M既能与酸反应又能与碱反应 |
| D.W与X或Z均可形成既含有离子键又含有非极性共价键的离子化合物 |
A.原子核外电子排布式为 的元素与原子核外电子排布式为 的元素与原子核外电子排布式为 的元素化学性质相似 的元素化学性质相似 |
B.基态碳原子的外围电子轨道表示式: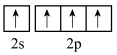 |
C.基态铜原子的外围电子轨道表示式: |
D. 的最外层电子排布式: 的最外层电子排布式: |
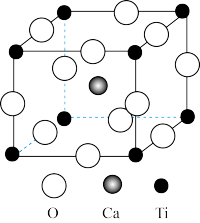
A.晶体的化学式为: |
| B.其组成元素中电负性最大的是:O |
C.Ti的基态原子价层电子排布式为: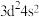 |
| D.金属离子与氧离子间的作用力为共价键 |
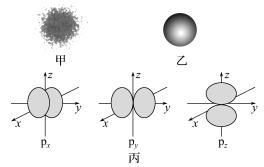
| A.电子云图(即概率密度分布图)就是原子轨道图 |
| B.3p2表示3p能级中有两个原子轨道 |
| C.由图乙可知,s能级的电子云轮廓图呈圆形,有无数条对称轴 |
| D.由图丙可知,p能级的原子轨道图呈哑铃形,且有3个伸展方向 |
| A.第五能层有5个能级,最多能容纳50个电子 |
| B.同一原子中,不同能层均含有的能级是s能级 |
| C.同一原子中,3d能级实际容纳的电子数一定为10个 |
| D.能层和能级的划分,均以电子的能量高低为依据 |
| A.第二电离能是气态基态+1价阳离子失去一个电子所需要的最小能量 |
| B.硫的第一电离能比磷的第一电离能小 |
| C.在所有元素中,氟的第一电离能最大 |
| D.某元素的第一电离能越小,表示在气态时该元素的原子越容易失去电子 |



