名校
1 . 已知用 检验
检验 时可得到蓝色沉淀
时可得到蓝色沉淀 ,该物质立方晶胞的
,该物质立方晶胞的 结构如图所示(
结构如图所示( 未画出),其中晶胞的边长为apm。下列说法错误的是
未画出),其中晶胞的边长为apm。下列说法错误的是
 检验
检验 时可得到蓝色沉淀
时可得到蓝色沉淀 ,该物质立方晶胞的
,该物质立方晶胞的 结构如图所示(
结构如图所示( 未画出),其中晶胞的边长为apm。下列说法错误的是
未画出),其中晶胞的边长为apm。下列说法错误的是
A.一个晶胞中含有4个 |
B. 周围最近的 周围最近的 数目为6 数目为6 |
C. 之间的最短距离为 之间的最短距离为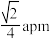 |
D.该物质的晶体密度为 |
您最近一年使用:0次
名校
解题方法
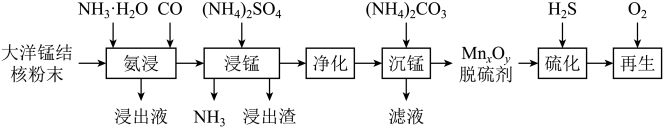
2 . 以大洋锰结核(主要由锰、铁的氧化物组成,还含有Cu等元素)为原料,制备脱硫剂 ,可用于脱除煤气中的
,可用于脱除煤气中的 。脱硫剂的制备、硫化、再生过程可表示如图:
。脱硫剂的制备、硫化、再生过程可表示如图:
(1)“氨浸”时,在浸出的 催化下,CO将结核中的
催化下,CO将结核中的 转化为
转化为 。发生反应的离子方程式为:
。发生反应的离子方程式为: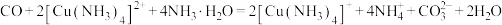 ;
;___________ 。
(2)“沉锰”中,若产生a mol 沉淀。现用5 L一定浓度的
沉淀。现用5 L一定浓度的 溶液将其全部转化为
溶液将其全部转化为 ,需
,需 溶液的浓度至少为
溶液的浓度至少为___________  (用含a的表达式表示)。已知:
(用含a的表达式表示)。已知: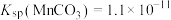 ,
,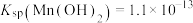 。
。
(3)上述过程中可循环的物质是___________ (填化学式)。
(4)“沉锰”得到的 在空气中煅烧可制得脱硫剂
在空气中煅烧可制得脱硫剂 。
。
①测得煅烧过程中固体残留率(固体残留率=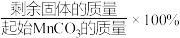 )随温度变化的曲线如图1所示。975 K时,煅烧
)随温度变化的曲线如图1所示。975 K时,煅烧 后得到固体产物为
后得到固体产物为___________ (填化学式)。

②工业上可以用石墨为电极电解硫酸锰和稀硫酸的混合液制备二氧化锰,其阳极电极反应为___________ 。
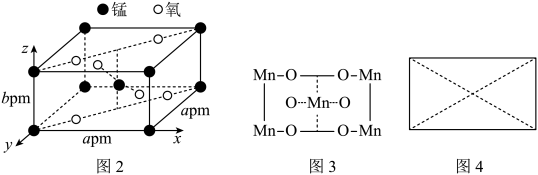
(5) 的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。
的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。_________
 ,可用于脱除煤气中的
,可用于脱除煤气中的 。脱硫剂的制备、硫化、再生过程可表示如图:
。脱硫剂的制备、硫化、再生过程可表示如图:
(1)“氨浸”时,在浸出的
 催化下,CO将结核中的
催化下,CO将结核中的 转化为
转化为 。发生反应的离子方程式为:
。发生反应的离子方程式为: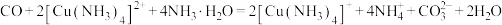 ;
;(2)“沉锰”中,若产生a mol
 沉淀。现用5 L一定浓度的
沉淀。现用5 L一定浓度的 溶液将其全部转化为
溶液将其全部转化为 ,需
,需 溶液的浓度至少为
溶液的浓度至少为 (用含a的表达式表示)。已知:
(用含a的表达式表示)。已知: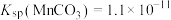 ,
,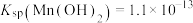 。
。(3)上述过程中可循环的物质是
(4)“沉锰”得到的
 在空气中煅烧可制得脱硫剂
在空气中煅烧可制得脱硫剂 。
。①测得煅烧过程中固体残留率(固体残留率=
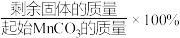 )随温度变化的曲线如图1所示。975 K时,煅烧
)随温度变化的曲线如图1所示。975 K时,煅烧 后得到固体产物为
后得到固体产物为
②工业上可以用石墨为电极电解硫酸锰和稀硫酸的混合液制备二氧化锰,其阳极电极反应为
(5)
 的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。
的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。
您最近一年使用:0次
名校
解题方法
3 . 碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
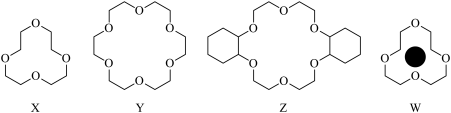
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___ 种运动状态不同的电子,其外围电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
③冠醚分子中氧的杂化轨道的空间构型是___ ,C—O—C的键角___ (填“>”“<”或“=”)109°28′。
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___ 个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加 德罗常数的值为NA,计算石墨晶体的层间距d为___ cm。
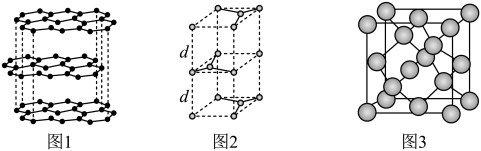
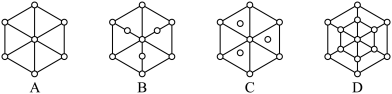
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
③冠醚分子中氧的杂化轨道的空间构型是
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为

(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图

您最近一年使用:0次
2020-06-23更新
|
1028次组卷
|
3卷引用:湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题
解题方法
4 . a、b、c、d、e是元素周期表中前四周期的元素,其原子序数依次增大,a为元素周期表中原子半径最小的元素,b的基态原子中占有电子的3个能级上的电子总数均相等,d与b同族,c与b同周期,且c的所有p轨道上的电子总数与所有s轨道上的电子总数相等,e的次外层电子数是其最外层电子的7倍。回答下列问题:
(1)c、d形成的化合物的晶体类型为___________ ;
(2)b、a c形成的三原子分子中,c原子的杂化方式为___________ ;
(3)b、c、d三种元素的电负性由小到大的顺序为___________ ;(用元素符号表示),d元素基态原子价层电子排布式为_________ ;
(4)金属Mg与a、e形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表e,深灰色小球代表Mg,浅灰色小球代表a,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:__________________ 。
(5)b、c、e能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和灰色小球代表。该配合物形成配位键时提供空轨道的原子是___________ (填元素符号),该配合物中大白球代表的元素的化合价为___________ 。

(6)①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________ 个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似_______
(1)c、d形成的化合物的晶体类型为
(2)b、a c形成的三原子分子中,c原子的杂化方式为
(3)b、c、d三种元素的电负性由小到大的顺序为
(4)金属Mg与a、e形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表e,深灰色小球代表Mg,浅灰色小球代表a,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:
(5)b、c、e能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和灰色小球代表。该配合物形成配位键时提供空轨道的原子是

(6)①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有
您最近一年使用:0次
名校
5 . I.如图所示为晶体A的结构,已知晶体A仅由一种元素X组成。X的一种单质可由金属镁与XY2气体加热反应获得。请回答下列问题:
(1)晶体A的名称为__________ 。
(2)晶体A中X原子的杂化方式为________ 。
(3)每个A原子参与形成______ 个6元环。
(4)将每个X原子视为一个球,若X原子的半径为R,1个晶胞中X原子的总体积为V,设一个晶胞的体积为V0,定义堆体积系数α= ,则该晶体的堆积系数α=
,则该晶体的堆积系数α=_____ (保留1位有效数字,取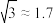 ,π≈3)
,π≈3)
(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线四等分点)
II.由分子光谱测得的断裂1个化学键所需的能量称为光谱解离能(D0),1个化学键包含的原子相互作用能称为平衡解离能(D1),两者的关系为
实验测得X-X键振动频率γ=2×1014Hz;
普朗克常数h=6×10-34J·s
阿伏伽德罗常数NA=6×1023mol-1
X为光谱常数。平衡解离能的计算式为 ;
;
由实验测得D1=6×10-19J;
用阿伏伽德罗常数NA乘D0得到断裂1mol化学键所需的能量E,E称为键能:E=NAD0。
请回答下列问题:
(1)X-X键的键能为______ kJ/mol。
(2)1mol晶体A中有_____ molX-X键。
(3)原子化热的定义为:断裂lmol晶体中所有化学键需要吸收的热量。原子晶体的原子化热类似于离子晶体的晶格能,那么晶体A的原子化热为______ kJ/mol。

(1)晶体A的名称为
(2)晶体A中X原子的杂化方式为
(3)每个A原子参与形成
(4)将每个X原子视为一个球,若X原子的半径为R,1个晶胞中X原子的总体积为V,设一个晶胞的体积为V0,定义堆体积系数α=
 ,则该晶体的堆积系数α=
,则该晶体的堆积系数α=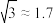 ,π≈3)
,π≈3)(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线四等分点)
II.由分子光谱测得的断裂1个化学键所需的能量称为光谱解离能(D0),1个化学键包含的原子相互作用能称为平衡解离能(D1),两者的关系为

实验测得X-X键振动频率γ=2×1014Hz;
普朗克常数h=6×10-34J·s
阿伏伽德罗常数NA=6×1023mol-1
X为光谱常数。平衡解离能的计算式为
 ;
;由实验测得D1=6×10-19J;
用阿伏伽德罗常数NA乘D0得到断裂1mol化学键所需的能量E,E称为键能:E=NAD0。
请回答下列问题:
(1)X-X键的键能为
(2)1mol晶体A中有
(3)原子化热的定义为:断裂lmol晶体中所有化学键需要吸收的热量。原子晶体的原子化热类似于离子晶体的晶格能,那么晶体A的原子化热为
您最近一年使用:0次
2017-04-07更新
|
596次组卷
|
2卷引用:湖南省湘潭市一中、长沙一中、师大附中、岳阳市一中、株洲市二中、常德市一中2017届高三下学期六校联考理综化学试题
名校
6 . 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是__________ (填元素符号,下同),电负性最大的是_________ 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___________ ,1 mol AB-中含有π键的数目为__________ ,黄血盐晶体中各种微粒间的作用力不涉及__________ (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为_____________ ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有
、④HCHO。其中碳原子采取sp2杂化的分子有___________ (填物质序号),HCHO分子的立体结构为______________ 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)__________________ 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_____________ 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为______________ cm。

(1)六种元素中第一电离能最小的是
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为
 、④HCHO。其中碳原子采取sp2杂化的分子有
、④HCHO。其中碳原子采取sp2杂化的分子有(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为

您最近一年使用:0次
2016-12-09更新
|
690次组卷
|
9卷引用:2015届湖南省长沙市长郡中学高三第二次联考理综化学试卷



