名校
1 . 过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是______(填标号)。
(2) 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。
①该配位化合物中心离子的价层电子排布式为______ ,中心离子的配位数为______ 。
②该配位化合物中含氮离子的中心原子的杂化类型为______ 。
(3)① 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是______ 。
②已知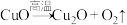 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因______ 。
(4) 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为______ g( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)下列有关说法正确的是______(填标号)。
| A.铜元素焰色试验的光谱为吸收光谱 |
| B.金属键没有方向性和饱和性 |
| C.基态铁原子核外未成对电子有4个 |
| D.锌属于过渡元素,处于元素周期表的d区 |
 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。①该配位化合物中心离子的价层电子排布式为
②该配位化合物中含氮离子的中心原子的杂化类型为
(3)①
 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是②已知
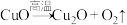 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因(4)
 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。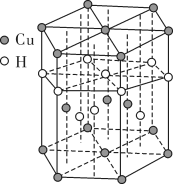
您最近一年使用:0次
名校
2 . 钛被称为继铁、铝之后的“第三金属”。一种制备金属钛的工艺流程如下所示:___________ 。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与CCl4相似。试预测CCl4的沸点___________ 136℃(填“>”“<”或“=”)并阐述推测理由___________ 。
(3)纳米TiO2是一种应用广泛的催化剂,其催化作用的一个实例如下所示:___________ 。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,该阳离子的结构片段如图所示。该阳离子中Ti与O的原子数之比为___________ 。___________ g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。

(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与CCl4相似。试预测CCl4的沸点
(3)纳米TiO2是一种应用广泛的催化剂,其催化作用的一个实例如下所示:

(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,该阳离子的结构片段如图所示。该阳离子中Ti与O的原子数之比为


您最近一年使用:0次
2024-05-05更新
|
116次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。
 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。
A.该晶体中存在 氢键 氢键 |
B. 中C原子为 中C原子为 杂化 杂化 |
C.基态原子的未成对电子数: |
D.基态原子的第一电离能: |
您最近一年使用:0次
2024-05-03更新
|
178次组卷
|
2卷引用:湖南省常德市石门县第一中学2023-2024学年高二下学期高考科目化学期中考试题
名校
4 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
177次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等多校2023-2024学年高二下学期入学考试化学试题
名校
5 . 乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等形成稳定环状离子,其中Cu2+与乙二胺形成的化合物稳定性更高。下列说法错误的是
| A.铜的第二电离能小于锌的第二电离能 |
| B.乙二胺中2个N原子均可与Cu2+形成配位键 |
| C.基态铜原子4s电子能量较高,总是在比3s电子离核更远的地方运动 |
| D.基态Mg原子中,电子占据的最高能层具有的原子轨道为9 |
您最近一年使用:0次
2024-04-05更新
|
103次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
6 . A、B、C、D、E是五种原子序数依次递增的短周期元素。已知:A的一种同位素可以用于测定文物的年代;基态C原子含3对成对电子;D在同周期金属元素中第一电离能最大;基态E原子的3p轨道中含有自旋方向不同且数目之比为3:1的电子。下列说法正确的是
| A.简单离子的离子半径:B<C<D<E |
| B.简单氢化物的沸点:A<B<C<E |
| C.D的单质可以在A和C形成的某种化合物中燃烧 |
| D.Xe(氙)是目前最易形成化合物的稀有气体,XeC3为非极性分子 |
您最近一年使用:0次
2024-04-04更新
|
934次组卷
|
4卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题吉林省吉林地区普通高中2024届高三三模考试化学试卷(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(新七省高考“15+4”)-2024年高考押题预测卷
名校
7 . 下列对有关事实的解释错误的是
| 选项事实 | 解释 | |
| A | 酸性:CF3COOH>CH3COOH | F电负性更大使羟基极性变强 |
| B | 金刚石的熔点高于单晶硅 | 金刚石的C-C比单晶硅的Si-Si键能大 |
| C | 稳定性:H2O>H2S | H-O键的键能比H-S键的键能大 |
| D | SiO2的熔点比干冰高 | SiO2比CO2相对分子质量大,分子间作用力大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-26更新
|
341次组卷
|
2卷引用:湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题
名校
8 . 下列对有关事实的解释错误的是
选项事实 | 解释 | |
A |
|
|
B |
|
|
C | 金刚石的熔点高于单晶硅 | 金刚石的C―C比单晶硅的Si―Si键能大 |
D | 某些金属盐灼烧时呈现不同焰色 | 电子从低能级轨道跃迁至高能级轨道后,又从高能级轨道跃迁至低能级轨道,释放出不同波长的光 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-25更新
|
277次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
解题方法
9 . 铁和硒(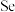 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)比较键角大小:气态 分子
分子_____ 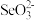 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_____ 。
(2)富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:

富马酸分子中 键与
键与 键的数目比为
键的数目比为_____ ;
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将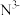 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:

产物中N原子的杂化轨道类型为_____ ;
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为_____ ;
②Fe原子的配位数为_____ ;
③该晶胞参数 、
、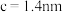 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_____  (列出计算式)。
(列出计算式)。
 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)比较键角大小:气态
 分子
分子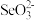 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁
 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
富马酸分子中
 键与
键与 键的数目比为
键的数目比为(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将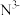 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
产物中N原子的杂化轨道类型为
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数
 、
、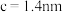 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
10 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。___________ 。
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为( )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为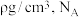 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ 。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

①铁、铝金属间化合物的化学式为
 )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标②则该立方晶胞的密度为
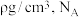 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次

 的熔点比干冰高
的熔点比干冰高 相对分子质量大,分子间作用力大
相对分子质量大,分子间作用力大 的酸性比
的酸性比 强
强

