名校
1 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近半年使用:0次
2024-04-26更新
|
175次组卷
|
2卷引用:广西壮族自治区桂林市联考2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 在科研和工农业生产中,硼、碳、氮、氧、磷、硫、铜等元素形成的单质及其化合物有着广泛的应用。请按要求回答下列问题:
(1)向盛有CuSO4溶液的试管中滴加少量氨水,现象是_______ ,离子反应方程式为_______ ;继续滴加氨水至过量得到深蓝色溶液;再加入乙醇后,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,其中配合物[Cu(NH3)4]SO4的配体为_______ (填化学式),中心离子为_______ 。
(2)锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,其中 中P原子的杂化方式为
中P原子的杂化方式为______ 。
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
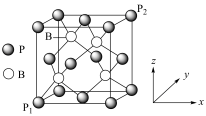
①磷原子的配位数(与磷原子距离最近且相等的硼原子数)为_______ 。
②已知图中原子坐标:P1为(0,0,0),P2为(1,1,1),则图中B的原子坐标是_______ 。
(1)向盛有CuSO4溶液的试管中滴加少量氨水,现象是
(2)锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,其中
 中P原子的杂化方式为
中P原子的杂化方式为(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:

①磷原子的配位数(与磷原子距离最近且相等的硼原子数)为
②已知图中原子坐标:P1为(0,0,0),P2为(1,1,1),则图中B的原子坐标是
您最近半年使用:0次
名校
3 . 某晶体立方晶胞如图所示。已知图中微粒1的分数坐标是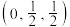 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
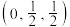 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
A. 周围距离最近且相等的 周围距离最近且相等的 个数是6 个数是6 |
B.微粒2的分数坐标是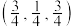 |
| C.已知银与铜位于同一族,银元素位于元素周期表的d区 |
D.若晶胞边长为a pm,则晶体密度为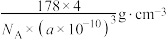 |
您最近半年使用:0次
2024-02-25更新
|
1152次组卷
|
5卷引用:广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题
广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题(已下线)选择题11-14安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
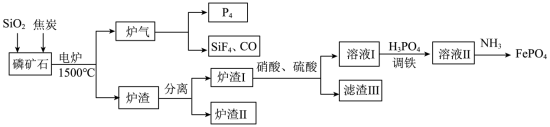
4 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分Ca5(PO4)3F,还有Fe2O3、CaCO3等杂质)为原料生产白磷(P4)同时制得刀片电池正极材料FePO4的工艺流程:
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是___________ (填“极性分子”或“非极性分子”)。
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:___________ 。
(3)炉渣Ⅱ的主要成分是___________ 。
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是___________ 。若此条件下Fe3+恰好完全转化为FePO4沉淀(当溶液中某离子浓度≤1×10−5mol/L时,可视为该离子沉淀完全),过滤,现往滤液中加入2mol/L的MgCl2溶液(设溶液体积增加1倍),此时溶液中___________ Mg3(PO4)2沉淀生成(填“有”或“无”或“无法确定”)【已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10−22、1.0×10−24】
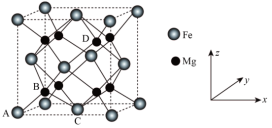
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示: ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为___________ 。此晶胞中Fe的配位数是___________ 。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
(3)炉渣Ⅱ的主要成分是
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为
您最近半年使用:0次
2024-02-03更新
|
710次组卷
|
3卷引用:2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
名校
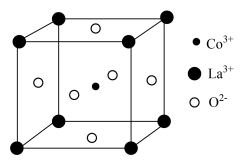
5 . 一种由镧( )、钴(
)、钴( )和氧(O)组成的三元氧化物催化剂材料,在环境保护、工业催化和光催化等领域有着广泛的应用。其晶胞结构如图所示,该立方晶胞参数为
)和氧(O)组成的三元氧化物催化剂材料,在环境保护、工业催化和光催化等领域有着广泛的应用。其晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 。下列说法错误的是
。下列说法错误的是
 )、钴(
)、钴( )和氧(O)组成的三元氧化物催化剂材料,在环境保护、工业催化和光催化等领域有着广泛的应用。其晶胞结构如图所示,该立方晶胞参数为
)和氧(O)组成的三元氧化物催化剂材料,在环境保护、工业催化和光催化等领域有着广泛的应用。其晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 。下列说法错误的是
。下列说法错误的是
A.晶体最简化学式为 |
B.晶体中与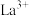 最近且距离相等的 最近且距离相等的 有6个 有6个 |
C.晶体的密度为 |
| D.晶体中相邻微粒间存在离子键 |
您最近半年使用:0次
6 . Mn是元素周期表中第25号元素,它的氧化物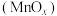 可用于催化醇的氧化氰化,反应如下:
可用于催化醇的氧化氰化,反应如下:
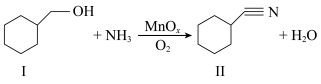
回答下列问题:
(1)组成物质Ⅰ的元素中,电负性最大是_____ (填元素符号)。
(2)物质Ⅱ中C原子的杂化轨道类型有_____ ; 该分子中含有
该分子中含有 键
键_____ mol。
(3) 的VSEPR模型为
的VSEPR模型为_____ ;已知 ,但该反应不及Na与
,但该反应不及Na与 的反应剧烈,从共价键的角度分析,可能的原因是
的反应剧烈,从共价键的角度分析,可能的原因是_____ 。
(4)Mn元素在周期表中的位置是_____ ;基态Mn原子的核外电子有_____ 种空间运动状态。
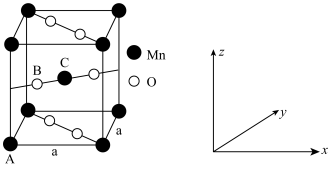
(5)某种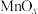 晶体的晶胞如下图所示,该晶体中Mn元素的化合价为
晶体的晶胞如下图所示,该晶体中Mn元素的化合价为_____ 。已知该晶胞底面是边长为 的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为
的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为 、
、 、
、 ,则Mn与O形成化学键的键长为
,则Mn与O形成化学键的键长为_____ cm(用含a、m、n的代数式表示)。
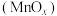 可用于催化醇的氧化氰化,反应如下:
可用于催化醇的氧化氰化,反应如下:
回答下列问题:
(1)组成物质Ⅰ的元素中,电负性最大是
(2)物质Ⅱ中C原子的杂化轨道类型有
 该分子中含有
该分子中含有 键
键(3)
 的VSEPR模型为
的VSEPR模型为 ,但该反应不及Na与
,但该反应不及Na与 的反应剧烈,从共价键的角度分析,可能的原因是
的反应剧烈,从共价键的角度分析,可能的原因是(4)Mn元素在周期表中的位置是
(5)某种
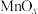 晶体的晶胞如下图所示,该晶体中Mn元素的化合价为
晶体的晶胞如下图所示,该晶体中Mn元素的化合价为 的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为
的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为 、
、 、
、 ,则Mn与O形成化学键的键长为
,则Mn与O形成化学键的键长为
您最近半年使用:0次
名校
解题方法
7 . 下列关于各晶体模型示意图的分析正确的是
| 名称 |  的晶胞 的晶胞 |  的晶胞 的晶胞 | 晶体碘的晶胞 | 石墨晶体的结构 |
| 模型 示意图 | 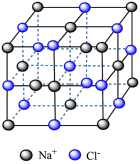 |  |  | 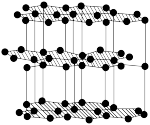 |
| 分析 | 1个 晶胞内含有6个 晶胞内含有6个 和6个 和6个 | B.Si原子的配位数为2 | C. 在晶胞中的排列有2种取向 在晶胞中的排列有2种取向 | D.石墨层与层间的主要作用力是共价键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-08-15更新
|
381次组卷
|
3卷引用:广西桂林市2022-2023学年高二下学期期末考试化学试题
名校
8 . 2020年8月19日发布的《新型冠状病毒肺炎诊疗方案(试行第八版)》中指出,氯喹类药物可用于治疗新冠肺炎,其中羟基氯喹结构如图所示。
(1)羟基氯喹分子中含氧官能团的名称为_____ 。
(2)羟基氯喹分子中基态Cl原子核外电子有_____ 种空间运动状态。
(3)羟基氯喹分子中C、N、O三种元素的电负性由小到大的顺序为_____ (用元素符号表示),第一电离能由小到大的顺序为_____ (用元素符号表示)。
(4)N原子的VSEPR模型为_____ 。
(5)请在答题卡中,用*标出羟基氯喹分子中的手性碳原子_____ 。
(6)下列现代分析手段中,可用于检测羟基氯的晶体结构是_____ 。

(1)羟基氯喹分子中含氧官能团的名称为
(2)羟基氯喹分子中基态Cl原子核外电子有
(3)羟基氯喹分子中C、N、O三种元素的电负性由小到大的顺序为
(4)N原子的VSEPR模型为
(5)请在答题卡中,用*标出羟基氯喹分子中的手性碳原子
(6)下列现代分析手段中,可用于检测羟基氯的晶体结构是
| A.X射线衍射 | B.原子光谱 | C.元素分析 | D.红外光谱 |
您最近半年使用:0次
2023-04-24更新
|
630次组卷
|
3卷引用:广西大学附属中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
9 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为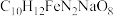 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
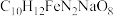 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: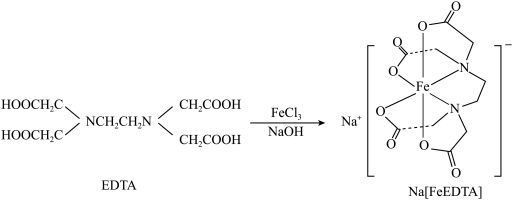
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.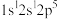 | B. | C. | D.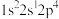 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
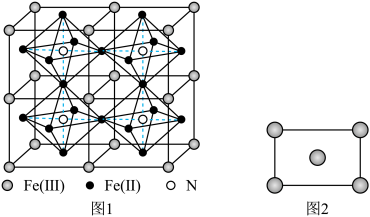
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
2023-04-23更新
|
829次组卷
|
8卷引用:广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题
广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
10 . 黑火药的爆炸反应原理为2KNO3+3C+S K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:
(1)基态O原子的核外电子排布式为___________ ;基态18O原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用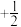 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.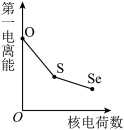 b.
b.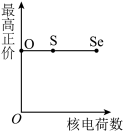 c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为___________ kJ/mol;O=O键的键能为___________ kJ/mol;氧原子的第一电子亲和能为___________ kJ/mol。
 K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:(1)基态O原子的核外电子排布式为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
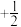 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为
您最近半年使用:0次
2023-03-10更新
|
392次组卷
|
2卷引用:广西南宁市2022-2023学年高二上学期期末教学质量调研化学试题



