解题方法
1 . 半导体在集成电路、消费电子、通信系统、光伏发电、照明、大功率电源转换等领域都有应用。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是_______ ,原因是_______ 。硅有晶体硅和无定形硅,可以用_______ (填方法名称)来区分晶体硅和无定形硅。
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,立方砷化硼中,_______ (填“含有”或“不含有”)配位键。
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为_______  ;晶胞密度为
;晶胞密度为_______  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用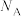 表示)。
表示)。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态
 原子的简化电子排布式为
原子的简化电子排布式为
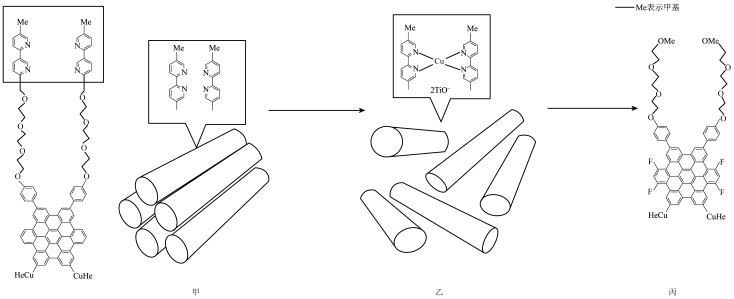
| A.分子识别和自组装是超分子的重要特征 |
B.甲分子中的氮原子的杂化方式均为 |
C.乙分子图示结构部分中,1个 形成了2个配位键 形成了2个配位键 |
| D.丙分子中存在氢键 |
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知
 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为 ;晶胞密度为
;晶胞密度为 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用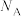 表示)。
表示)。
您最近一年使用:0次
名校
2 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):______ 。
Ⅲ.LiBH4是储氢材料,已知其由Li+和 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的位置______ 。
(5)由元素周期律能得到______。(填序号)
(6)LiBH4中不存在的作用力有______(填序号)。
(7)氢化锂(LiH)是离子化合物。写出其电子式______ ,LiH中负离子半径大于正离子半径,其原因是______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为______ 个。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
| A.C60、Si60、N60分子内部的作用力是共价键 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
Ⅲ.LiBH4是储氢材料,已知其由Li+和
 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。(4)锂位于元素周期表的位置
(5)由元素周期律能得到______。(填序号)
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.沸点:H2O大于HF | D.酸性:HCl大于H2SO3 |
(6)LiBH4中不存在的作用力有______(填序号)。
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(7)氢化锂(LiH)是离子化合物。写出其电子式
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
您最近一年使用:0次
解题方法
3 . 刀片电池(The blade battery)是比亚迪于2020年3月29日发布的电池产品。正极材料使用了磷酸亚铁锂( ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: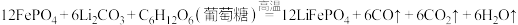 。回答下列问题:
。回答下列问题:
(1)Li位于元素周期表的_____ 区,基态Fe原子的价电子排布式为_________ 。
(2)同周期元素中,第一电离能大于O的原子是_______ 。
(3)有关 叙述正确的是___________。
叙述正确的是___________。
(4) 的空间结构为
的空间结构为______ ,其中P采取____ 杂化方式。
(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是______ ,解释易溶于水的原因_______ 。
 ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: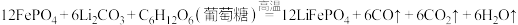 。回答下列问题:
。回答下列问题:(1)Li位于元素周期表的
(2)同周期元素中,第一电离能大于O的原子是
(3)有关
 叙述正确的是___________。
叙述正确的是___________。A.分子中 键和 键和 键个数比为1:1 键个数比为1:1 | B.含有极性键的非极性分子 |
C.分子空间结构与 相同 相同 | D.熔点、沸点高于 |
 的空间结构为
的空间结构为(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是
您最近一年使用:0次
2024-01-13更新
|
220次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二上学期1月期末化学试题
名校
4 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
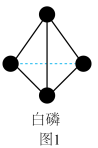
①白磷(P4)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③电负性:P___________ (填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
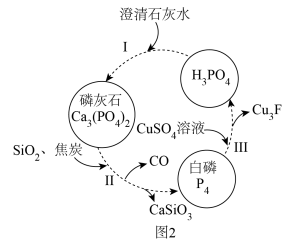
①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知:Cu3P不溶于水)。
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(P4)的相对分子质量为
②基态P原子中成对电子数与未成对电子数之比为
③电负性:P
(2)磷,及其部分重要化合物的相互转化如图2所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为
(3)反应Ⅲ的离子方程式为
您最近一年使用:0次
2024-01-10更新
|
131次组卷
|
2卷引用:辽宁省抚顺市六校协作体2023-2024学年高二上学期期末考试化学试题
解题方法
5 . 氯化铍(BeO)高温下导热性能良好,具有一定的防核辐射作用,常用于制合金、催化剂和耐火材料等。利用金绿宝石共生矿(主要成分是BeAl2O4,含少量铁的氧化物、石英)制备氧化铍和副产品铵明矾 的工艺流程如下:
的工艺流程如下:

已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“熔炼”的作用是___________ 。
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:___________ 。①充分反应,提高浸出率;②____________ 。
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:
__________ ↑+__________  。
。
(4)“氧化”时加入H2O2的目的是___________ 。“调pH”的范围是________ 。
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为_______________ 。
②若晶胞参数为anm,设阿伏加德罗常数的值为 ,则BeO晶体的密度
,则BeO晶体的密度
________ g·cm-3。
 的工艺流程如下:
的工艺流程如下:
已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Be2+ |
| 开始沉淀pH | 1.5 | 3.3 | 6.5 | 5.2 |
| 完全沉淀pH | 3.7 | 5.0 | 9.7 | 8.8 |
(1)“熔炼”的作用是
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:

 。
。(4)“氧化”时加入H2O2的目的是
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为
②若晶胞参数为anm,设阿伏加德罗常数的值为
 ,则BeO晶体的密度
,则BeO晶体的密度
您最近一年使用:0次
名校
解题方法
6 . 普鲁士蓝可用作钠离子电池的正极材料。放电时 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: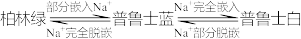 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
| A.从结构上分析,基态Fe3+比基态Fe2+相对更稳定 |
B.普鲁士蓝晶胞中 填充率等于50% 填充率等于50% |
| C.图2中σ键和π键的数目之比为3:2 |
| D.普鲁士白的化学式为NaFe2(CN)6 |
您最近一年使用:0次
2023-09-08更新
|
298次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题
名校
解题方法
7 . 下列说法错误的是
| A.晶体的自范性是晶体中粒子在微观空间呈现周期性的有序排列的宏观表象 |
| B.X射线衍射实验是区分晶体和非晶体最可靠的方法 |
| C.等离子体是一种特殊的液体,由带电的阳离子、电子及电中性粒子的组成 |
| D.液晶既有液体的流动性,又具有类似晶体的各向异性 |
您最近一年使用:0次
2023-09-08更新
|
512次组卷
|
5卷引用:辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题
辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题(已下线)选择题1-5(已下线)第三章晶体结构与性质(B卷)四川省南充高级中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
8 . 下列关于各晶体模型示意图的分析正确的是
| 名称 |  的晶胞 的晶胞 |  的晶胞 的晶胞 | 晶体碘的晶胞 | 石墨晶体的结构 |
| 模型 示意图 | 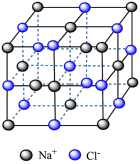 |  |  | 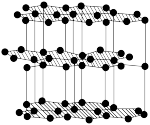 |
| 分析 | 1个 晶胞内含有6个 晶胞内含有6个 和6个 和6个 | B.Si原子的配位数为2 | C. 在晶胞中的排列有2种取向 在晶胞中的排列有2种取向 | D.石墨层与层间的主要作用力是共价键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-15更新
|
381次组卷
|
3卷引用:辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题
9 . 氢能备受人们的关注,储氢材料的研究对于氢能的储运和开发具有重要意义。回答下列问题:
Ⅰ.储氢材料氨硼烷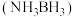 储氢容量高,常温常压下为白色晶体,熔点
储氢容量高,常温常压下为白色晶体,熔点 ,易溶于水。
,易溶于水。
(1) 晶体的晶体类型为
晶体的晶体类型为___________ 晶体。
(2) 易溶于水的主要原因是
易溶于水的主要原因是___________ 。
(3) 中
中 都达到稳定结构,
都达到稳定结构, 分子的结构式为
分子的结构式为___________ (用“ ”表示配位键)。
”表示配位键)。
Ⅱ.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
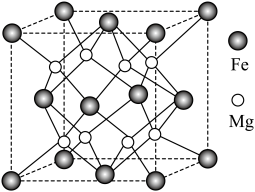
(4) 原子位于
原子位于 原子构成的
原子构成的___________ 面体空隙中。
(5)铁镁合金的化学式为___________ 。
(6)若该晶胞的边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该合金的密度为
,则该合金的密度为___________  (用含
(用含 的表达式表示)。
的表达式表示)。
(7)若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含
分子在晶胞的体心和棱心位置,则含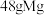 的该储氢合金可储存
的该储氢合金可储存 (标准状况)的体积约为
(标准状况)的体积约为___________ L。
Ⅰ.储氢材料氨硼烷
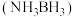 储氢容量高,常温常压下为白色晶体,熔点
储氢容量高,常温常压下为白色晶体,熔点 ,易溶于水。
,易溶于水。(1)
 晶体的晶体类型为
晶体的晶体类型为(2)
 易溶于水的主要原因是
易溶于水的主要原因是(3)
 中
中 都达到稳定结构,
都达到稳定结构, 分子的结构式为
分子的结构式为 ”表示配位键)。
”表示配位键)。Ⅱ.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

(4)
 原子位于
原子位于 原子构成的
原子构成的(5)铁镁合金的化学式为
(6)若该晶胞的边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该合金的密度为
,则该合金的密度为 (用含
(用含 的表达式表示)。
的表达式表示)。(7)若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含
分子在晶胞的体心和棱心位置,则含 的该储氢合金可储存
的该储氢合金可储存 (标准状况)的体积约为
(标准状况)的体积约为
您最近一年使用:0次
名校
10 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型分子Ⅳ的合成路线如下:

(1)Se与S同族,基态硒原子价电子排布式为_______ ,硒元素位于元素周期表的_______ 区。
(2)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有_______ 。
a.Ⅰ中仅有σ键
b.Ⅰ中的Se—Se键为非极性共价键
c.Ⅱ易溶于水
d.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
e.Ⅰ~Ⅲ含有的元素中,O电负性最大
(3)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。 的空间构型为
的空间构型为_______ 。
(4)化合物X是某种潜在材料,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为_______ 。
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为_______ nm(列出计算式,NA为阿伏加德罗常数的值)。
(5)烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为_______ (填序号)。
a. b.
b.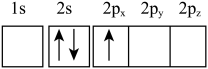 c.
c. d.
d. 

(1)Se与S同族,基态硒原子价电子排布式为
(2)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
a.Ⅰ中仅有σ键
b.Ⅰ中的Se—Se键为非极性共价键
c.Ⅱ易溶于水
d.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
e.Ⅰ~Ⅲ含有的元素中,O电负性最大
(3)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。
 的空间构型为
的空间构型为(4)化合物X是某种潜在材料,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为
(5)烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为
a.
 b.
b. c.
c. d.
d. 
您最近一年使用:0次



