1 . a、b、c、d、e为前四周期元素(除稀有气体),原子序数依次增大。a的基态原子价电子层有3个未成对电子;b元素常见的盐可用于纺织、制皂、制玻璃和焙制糕点;c元素的盐类大多具有硬度高、熔点高、难溶于水、化学性质稳定等特点;d元素原子在同周期元素中原子半径最小;e元素在地壳中的含量排在第四位;回答下列问题:
(1)在一定条件下,a的简单氢化物与其正四价的氧化物可转化为 ,每生成1mol
,每生成1mol 时转移
时转移___________ mol电子;汽车安全气囊中含有 ,受撞击使分解产生b单质和
,受撞击使分解产生b单质和 ,若产生40.32L(标准状况下)
,若产生40.32L(标准状况下) ,至少需要
,至少需要
___________ g。
(2)将一定量 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为___________ 。
(3)c元素的氧化物中c原子的杂化方式___________ 。
(4)c元素与d形成化合物 ,
, 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为___________ 。
(5)d元素形成的单质在强碱性环境下能将e元素的红褐色难溶碱氧化成+6价的含氧酸根,写出离子方程式___________ 。
(1)在一定条件下,a的简单氢化物与其正四价的氧化物可转化为
 ,每生成1mol
,每生成1mol 时转移
时转移 ,受撞击使分解产生b单质和
,受撞击使分解产生b单质和 ,若产生40.32L(标准状况下)
,若产生40.32L(标准状况下) ,至少需要
,至少需要
(2)将一定量
 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为(3)c元素的氧化物中c原子的杂化方式
(4)c元素与d形成化合物
 ,
, 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为(5)d元素形成的单质在强碱性环境下能将e元素的红褐色难溶碱氧化成+6价的含氧酸根,写出离子方程式
您最近一年使用:0次
2011·辽宁·二模
2 . A、B、C、D为原子序数依次增大的短周期元素。A原子核外电子有5种运动状态,B是地壳中含量最多的元素,A、C、D未成对电子数比为1:3:1。E有“生物金属”之称,E4+和氩原子的核外电子排布相同,请回答下列问题:(各元素用相应的元素符号表示)

(1)五种元素所形成的XY3型化合物的化学式可能为________ ,其中心原子杂化方式依次为____________ 。
(2)在元素周期表中与C同周期但不同区的金属元素有___ 种。
(3)B与D形成的以D为中心三原子分子中,B的质量分数约为47%,则分子的空间构型为__ 。
(4)E的一种氧化物M的晶胞结构如图所示,则M的化学式为_____ ,该晶体中氧原子的配位数为___ 。
(5)下列晶体的堆积方式与E的单质晶体的堆积方式相同的有_______ 。
①Po ②Zn ③Ag ④K
(6)B可形成两种同素异形体,其中在水中溶解度更大的是______ (填化学式),原因是_____________________________ 。

(1)五种元素所形成的XY3型化合物的化学式可能为
(2)在元素周期表中与C同周期但不同区的金属元素有
(3)B与D形成的以D为中心三原子分子中,B的质量分数约为47%,则分子的空间构型为
(4)E的一种氧化物M的晶胞结构如图所示,则M的化学式为
(5)下列晶体的堆积方式与E的单质晶体的堆积方式相同的有
①Po ②Zn ③Ag ④K
(6)B可形成两种同素异形体,其中在水中溶解度更大的是
您最近一年使用:0次
22-23高三上·江西抚州·阶段练习
名校
3 . 钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子电池的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:

【资料】①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
(1)K3V2(PO4)3中V的化合价为____ 。
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是____ 。
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,在焙烧物料中加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
d.调控料层厚度为窑体的 高度
高度
②焙烧过程中主要反应的化学方程式为____ 。
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5mmol、7.5mmol、7.5mmol依次溶解于20mL去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4•2H2O,搅拌至溶液变为黄绿色,草酸的量对K3V2(PO4)3形貌的影响如表:
①实验条件下束状碳包覆K3V2(PO4)3纳米线样品制备的最佳条件为____ 。
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因是____ 。
(4)加入的草酸晶体是过量的,其中只有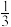 的草酸为还原剂,将VO
的草酸为还原剂,将VO 还原成VO2+,
还原成VO2+, 的草酸以C2O
的草酸以C2O 的形式存在,此过程中反应的离子方程式为
的形式存在,此过程中反应的离子方程式为____ 。
(5)“氩气中煅烧”时,氩气的作用是____ 。
(6)某工厂利用上述工艺流程,用10t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为____ 。

【资料】①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 |
| 主要离子 | VO | VO |
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,在焙烧物料中加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
d.调控料层厚度为窑体的
 高度
高度②焙烧过程中主要反应的化学方程式为
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5mmol、7.5mmol、7.5mmol依次溶解于20mL去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4•2H2O,搅拌至溶液变为黄绿色,草酸的量对K3V2(PO4)3形貌的影响如表:
| 草酸的量 | K3V2(PO4)3形貌 |
| 0 | 杂乱的微米颗粒 |
| 1.0g | 少量杂乱的纳米线 |
| 2.0g | 有束状的形貌出现 |
| 4.0g | 大部分为束状纳米线 |
| 6.0g | 均一的束状纳米线 |
| 12.0g | 纳米线的均一性较差 |
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因是
(4)加入的草酸晶体是过量的,其中只有
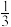 的草酸为还原剂,将VO
的草酸为还原剂,将VO 还原成VO2+,
还原成VO2+, 的草酸以C2O
的草酸以C2O 的形式存在,此过程中反应的离子方程式为
的形式存在,此过程中反应的离子方程式为(5)“氩气中煅烧”时,氩气的作用是
(6)某工厂利用上述工艺流程,用10t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为
您最近一年使用:0次
4 . 铝是地壳中含量最丰富的金属元素。铝及其化合物在航空、建筑、汽车等工业领域有着重要的应用。工业上以冰晶石为助熔剂电解熔融氧化铝冶炼铝。请根据物质结构与性质的相关知识回答下列问题:

(1) 化学键中离子键的百分数为41%,则
化学键中离子键的百分数为41%,则 应作为
应作为___________ 晶体(填晶体类型)来处理。
(2)冰晶石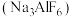 能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“
能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“ ”所代表的微粒是
”所代表的微粒是___________ 。
(3)氯化铝的熔点为194℃,易升华,氯化铝属于___________ 晶体(填晶体类型)。氯化铝常以二聚体的形式存在其结构模型为 ,一个二聚体中含有配位键
,一个二聚体中含有配位键___________ 个,铝原子的杂化方式为___________ 。
(4) 在一定条件下可制得熔点和硬度都很高的
在一定条件下可制得熔点和硬度都很高的 晶体,晶胞结构如图乙所示,则一个晶胞中含有
晶体,晶胞结构如图乙所示,则一个晶胞中含有___________ 个N原子, 的配位数为
的配位数为___________ 。
(5)金属铝的晶胞如图丙所示:晶胞边长为 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。

(1)
 化学键中离子键的百分数为41%,则
化学键中离子键的百分数为41%,则 应作为
应作为(2)冰晶石
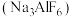 能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“
能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“ ”所代表的微粒是
”所代表的微粒是(3)氯化铝的熔点为194℃,易升华,氯化铝属于
 ,一个二聚体中含有配位键
,一个二聚体中含有配位键(4)
 在一定条件下可制得熔点和硬度都很高的
在一定条件下可制得熔点和硬度都很高的 晶体,晶胞结构如图乙所示,则一个晶胞中含有
晶体,晶胞结构如图乙所示,则一个晶胞中含有 的配位数为
的配位数为(5)金属铝的晶胞如图丙所示:晶胞边长为
 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
解题方法
5 . 氨是是重要的无机化工产品之一, 氨的合成及应用均是工业上的研究热点。请回答下列相关问题:
(1)N 原子的价层电子排布式为___________ ;NH3经 F 取代后可得到NF3,请比较键角 NH3___________ NF3(填“>”或“<”)。
(2)合成氨反应过程中各物质的物质的量(mol)与能量(kJ)变化如下图所示:
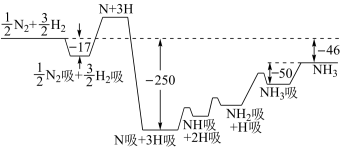
已知H-H 键能为 435.8 kJ·mol-1,N≡N 键能为 944.8 kJ·mol-1,则 N-H 键能为___________ 。
(3)氨的氧化是工业生产硝酸的重要步骤,反应方程式如下:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)H=-907.28kJ·mol-1 ①
除反应①外,还会发生下列两个副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O (g)H=-1104.9kJ·mol-1 ②
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)H=-1269.02kJ·mol-1 ③
三个反应的 lgKp 与温度的关系图为___________ (填“a”或“b”);
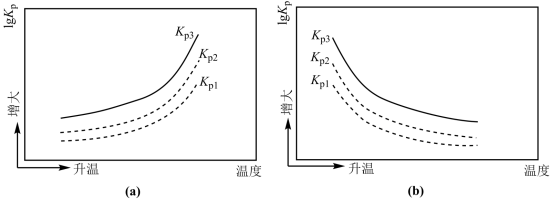
由图可见反应③趋势最大,氨和氧气的主要产物应是氮气,但实际生产中 NO 产率可以达到 95-97%,则采取的有效措施可能为___________ 。
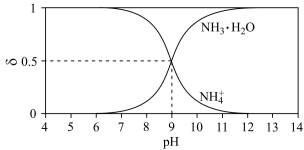
(4)常温下氨水平衡体系中,各组分的分布系数与 pH 的关系如下图所示。
NH3·H2O 的电离常数 Kb 值为___________ 。
(5)一般采用氨水沉淀法去除Cr3+,我国(GB/T14848—93)规定生活用水中铬离子含量不超过 10-4mol·L-1.若处理后的废水溶液中 c(NH )/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准
)/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准___________ 。(已知 Ksp[Cr(OH)3]≈1×10-31)
(1)N 原子的价层电子排布式为
(2)合成氨反应过程中各物质的物质的量(mol)与能量(kJ)变化如下图所示:

已知H-H 键能为 435.8 kJ·mol-1,N≡N 键能为 944.8 kJ·mol-1,则 N-H 键能为
(3)氨的氧化是工业生产硝酸的重要步骤,反应方程式如下:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)H=-907.28kJ·mol-1 ①
除反应①外,还会发生下列两个副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O (g)H=-1104.9kJ·mol-1 ②
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)H=-1269.02kJ·mol-1 ③
三个反应的 lgKp 与温度的关系图为

由图可见反应③趋势最大,氨和氧气的主要产物应是氮气,但实际生产中 NO 产率可以达到 95-97%,则采取的有效措施可能为
(4)常温下氨水平衡体系中,各组分的分布系数与 pH 的关系如下图所示。

NH3·H2O 的电离常数 Kb 值为

(5)一般采用氨水沉淀法去除Cr3+,我国(GB/T14848—93)规定生活用水中铬离子含量不超过 10-4mol·L-1.若处理后的废水溶液中 c(NH
 )/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准
)/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准
您最近一年使用:0次
解题方法
6 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为________ (用元素符号表示)。
(3)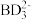 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为________ 杂化;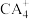 的空间构型为
的空间构型为________ 。
(4)化合物B2A4中含有σ键与π键的个数比为________ 。
(5)比较D、E元素最简单氢化物的沸点高低________ (用化学式表示),理由是________ (用文字表达)。
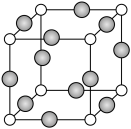
(6)C、F两元素形成的某化合物的晶胞结构如图所示,顶点为C原子,则该化合物的化学式是________ ,C原子的配位数是________ ,若相邻C原子和F原子间的距离为acm,阿伏加 德罗常数为NA,则该晶体的密度为________ g/cm3(用含a、NA的符号表示)。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
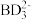 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为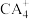 的空间构型为
的空间构型为(4)化合物B2A4中含有σ键与π键的个数比为
(5)比较D、E元素最简单氢化物的沸点高低
(6)C、F两元素形成的某化合物的晶胞结构如图所示,顶点为C原子,则该化合物的化学式是

您最近一年使用:0次
名校
解题方法
7 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________ 方法区分其结晶形和无定形的两种存在形态,c的价电子排布图为______________________________ 。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是______ ;
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是___________ 。
(3)用“>”或“<”填空:
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____ 个e原子。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构______________ (要求画出配位键)。
(1)c、d两种元素形成的化合物统称硅石,可通过
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b | dc2晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构
您最近一年使用:0次
名校
解题方法
8 . 砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________ ;砷与溴的第一电离能较大的是____________ 。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________ ,与其互为等电子体的一种分子为________ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________ ,As原子采取________ 杂化。
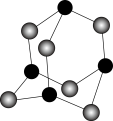
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
(1)基态砷原子的电子排布式为
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为

(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
您最近一年使用:0次
2020-04-27更新
|
61次组卷
|
2卷引用:辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题
解题方法
9 . 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____ 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________ 。
(3)E的最高价氧化物分子的空间构型是__________ ,是____ 分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________ 。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________ 。(a)中E原子的配位数为____ 。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____ 个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____ (b)(填“>”“<”或“=”)。
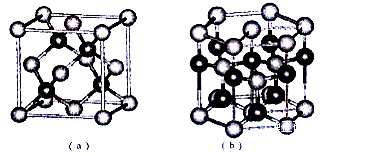
(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是
(3)E的最高价氧化物分子的空间构型是
(4)F原子的核外电子排布式是
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为

您最近一年使用:0次
2017-10-07更新
|
227次组卷
|
3卷引用:辽宁省师范大学附属中学2018届高三上学期期中考试化学试题
10 . 过渡金属元素的单质及化合物在科学研究和工业生产中具有许多用途,根据所学知识回答下列问题:
(1)基态Ni2+的核外电子排布式_______________ ;配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,固态Ni(CO)4,属于_______________ 晶体;镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的价电子排布为3d10,则其杂化轨道类型为_______________ ,Ni(CO)4是_______________ (填“极性”或“非极性” )分子。
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为_______________ ;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含_______________ 个配位键。

(3)铜能与类卤素(SCN)2 反应生成 Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为__________ ; 类卤素 (SCN)2 对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______________ 。
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为_______________ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。

人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为_______________ 。

(1)基态Ni2+的核外电子排布式
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为

(3)铜能与类卤素(SCN)2 反应生成 Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为

人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为

您最近一年使用:0次
2017-06-10更新
|
523次组卷
|
2卷引用:辽宁省葫芦岛协作体2017届高三下学期模拟考试(6月)化学试卷



