名校
解题方法
1 . 超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知: 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。

(1) 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是___________ (填标号)。
A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C. 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快
(2) 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。
①基态 的核外电子空间运动状态有
的核外电子空间运动状态有___________ 种。
② 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为___________ ,该晶体密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ pm。

(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠( )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。
①样品中铁元素的质量分数为___________ %。
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为___________ 。
已知:
 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
(1)
 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C.
 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快(2)
 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。①基态
 的核外电子空间运动状态有
的核外电子空间运动状态有②
 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为 ,则该晶胞的棱长为
,则该晶胞的棱长为
(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠(
 )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。①样品中铁元素的质量分数为
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。___________ 。
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为( )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为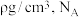 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ 。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

①铁、铝金属间化合物的化学式为
 )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标②则该立方晶胞的密度为
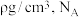 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次
3 . 湖南省成矿地质条件优越,矿产资源丰富,优质矿产多且分布相对集中,在国内外享有盛誉。在已探明储量的矿种中,钒、锰、锌、锡、磷、硫等的含量在全国均位于前列。
请回答下列问题:
(1)基态V原子的价层电子排布图为_______ 。磷的第一电离能_______ (填“大于”或“小于”)硫的第一电离能。
(2)锡与氯、溴、碘可以形成四卤化物。熔沸点数据如表所示:
 、
、 、
、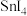 的熔沸点逐渐升高的原因是
的熔沸点逐渐升高的原因是_______ 。
(3)二麦芽酚锌是锌的一种配位化合物,其结构如图1所示。配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。二麦芽酚锌中锌的配位数为_______ ,其中非金属元素的电负性由大到小的顺序是_______ (填元素符号),其中碳原子的杂化类型为_______ 。

(4)MnS的晶胞结构如图2所示。

①以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号 的坐标为(0,0,0),3号
的坐标为(0,0,0),3号 的坐标为(1,1,1),则2号
的坐标为(1,1,1),则2号 的坐标为
的坐标为_______ 。
②离中心 最近且等距离的
最近且等距离的 有
有_______ 个,所围成的空间结构为_______ 。
③已知NA代表阿伏加德罗常数的值,晶胞参数为anm,则MnS晶胞的密度为_______ (用含NA、a的代数式表示)g/cm3。
请回答下列问题:
(1)基态V原子的价层电子排布图为
(2)锡与氯、溴、碘可以形成四卤化物。熔沸点数据如表所示:
 |  | 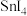 | |
| 熔点/℃ | -33 | 31 | 144.5 |
| 沸点/℃ | 114.1 | 202 | 364 |
 、
、 、
、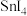 的熔沸点逐渐升高的原因是
的熔沸点逐渐升高的原因是(3)二麦芽酚锌是锌的一种配位化合物,其结构如图1所示。配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。二麦芽酚锌中锌的配位数为

(4)MnS的晶胞结构如图2所示。

①以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号
 的坐标为(0,0,0),3号
的坐标为(0,0,0),3号 的坐标为(1,1,1),则2号
的坐标为(1,1,1),则2号 的坐标为
的坐标为②离中心
 最近且等距离的
最近且等距离的 有
有③已知NA代表阿伏加德罗常数的值,晶胞参数为anm,则MnS晶胞的密度为
您最近一年使用:0次
解题方法
4 . 根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]_______ ,有_______ 组相同能量的电子。
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是_______ 。
(3)氧与氮可形成正离子NO ,其空间构型为
,其空间构型为_______ ,碳与氢也可形成正离子CH ,该离子中,碳的杂化方式为
,该离子中,碳的杂化方式为_______ 。
(4)原子的电子亲和能是指在0K下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。

由图可知,Mg原子的第一电离能为_______ kJ·mol-1,O=O键键能为_______ kJ·mol-1,氧原子的第二电子亲和能为_______ kJ·mol-1。
(5)氢化镁(MgH2)与金属锌在一定条件下研磨,可制得化合物Mg2ZnH4,X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被锌原子占据,所有镁原子的配位数都相等。
①该晶胞中镁原子个数为_______ 。
②已知Mg2ZnH4晶体的晶胞参数为a pm,镁原子分布在该晶胞中锌原子形成的四面体中心。该晶胞中相邻镁原子与锌原子之间距离为_______ pm,Mg2ZnH4晶体密度为_______ g·cm-3(阿伏加德罗常数的值用NA表示)。
(1)基态Fe原子的核外电子排布式为[Ar]
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是
(3)氧与氮可形成正离子NO
 ,其空间构型为
,其空间构型为 ,该离子中,碳的杂化方式为
,该离子中,碳的杂化方式为(4)原子的电子亲和能是指在0K下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。

由图可知,Mg原子的第一电离能为
(5)氢化镁(MgH2)与金属锌在一定条件下研磨,可制得化合物Mg2ZnH4,X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被锌原子占据,所有镁原子的配位数都相等。
①该晶胞中镁原子个数为
②已知Mg2ZnH4晶体的晶胞参数为a pm,镁原子分布在该晶胞中锌原子形成的四面体中心。该晶胞中相邻镁原子与锌原子之间距离为
您最近一年使用:0次
2021-03-08更新
|
439次组卷
|
3卷引用:湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题
湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题河南省九师联盟2021届高三下学期2月联考理综化学试题(已下线)03 物质结构与性质综合题型集训(3) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
5 . 0128应用纳米技术制备的纳米金属燃料已应用到社会生活和高科技领域.一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如图所示。请回答下列问题:
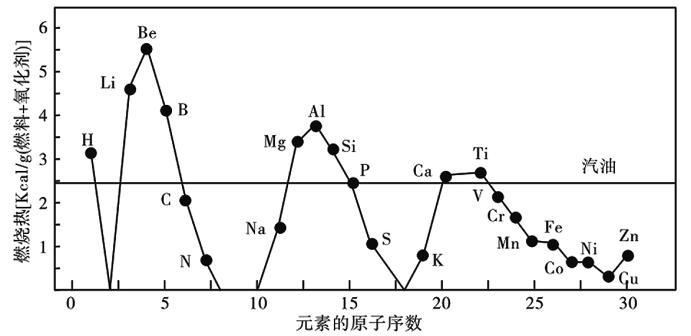
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是_______ (填写元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是____ (填一项)。
(2)Be粉和MnO2粉末在高温下可以反应(类似铝热反应),每消耗1gBe放出akJ热量,请写出该反应的热化学方程式_________ 。
(3)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图:
①溶解铜帽时加入H2O2的目的是_________ (用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是___ 。
为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式为:2Cu2++4I-=2CuI(白色)↓+I2 2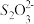 +I2=I-+
+I2=I-+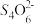 。
。
③滴定选用的指示剂为_____ ,滴定终点观察到的现象为_____ 。
④若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会______ (填“偏高”、“偏低”或“不变”)。

(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是
(2)Be粉和MnO2粉末在高温下可以反应(类似铝热反应),每消耗1gBe放出akJ热量,请写出该反应的热化学方程式
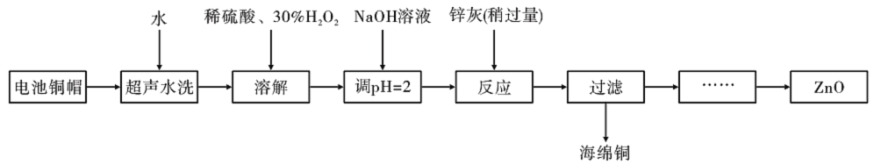
(3)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图:

①溶解铜帽时加入H2O2的目的是
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是
为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式为:2Cu2++4I-=2CuI(白色)↓+I2 2
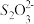 +I2=I-+
+I2=I-+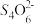 。
。③滴定选用的指示剂为
④若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会
您最近一年使用:0次
名校
解题方法
6 . 今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________ 、B________ 、C________ 、D________ 。
(2)写出A元素原子的核外电子排布式:____________ ;写出B元素原子核外电子排布的价电子构型:__________ ;用电子排布图表示C原子的核外电子排布情况:_______________ 。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________ ;电负性____________ 。
(1)试推断A、B、C、D四种元素的符号:A
(2)写出A元素原子的核外电子排布式:
(3)比较四种元素的第一电离能和电负性的大小:第一电离能
您最近一年使用:0次
2018-12-04更新
|
491次组卷
|
10卷引用:湖南省长沙市明达中学2021-2022学年高二上学期期末考试化学试题
湖南省长沙市明达中学2021-2022学年高二上学期期末考试化学试题四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷云南省澄江二中2018-2019学年高二上学期期中考试化学试题云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题鲁科版2019选择性必修2第1章 原子结构与元素性质 第1章学科素养提升(人教版2019)选择性必修2第一章 原子结构与性质 学科素养提升海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题
解题方法
7 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;B元素原子中的未成对电子数为_______________________ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______ ;A与B形成的AB2-的空间构型为___________________________ 。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________________ (用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________ ;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________ ;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________ 。
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为__________________________ 。
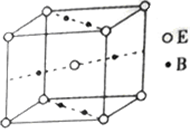
(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
(3)A、B、C三种元素的第一电离能从大到小的顺序为
(4)基态F3+的核外电子排布式是
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
8 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是_____________ 。
(2)B的最高价含氧酸根的空间构型为__________________ 。
(3)A、B、D三种元素电负性由大到小排列顺序为____________ 。
(4)D单质比化合物DA的熔点____ (填“高”或“低”),理由是_______________ 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式___________________________ 。
(1)E原子核外电子排布式是
(2)B的最高价含氧酸根的空间构型为
(3)A、B、D三种元素电负性由大到小排列顺序为
(4)D单质比化合物DA的熔点
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
2卷引用:2015届湖南省衡阳市高三4月模拟练习卷理科综合化学试卷



