名校
解题方法
1 . 钴及其化合物有重要的用途,研究其结构有重要意义。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是 。
。____ 在元素周期表中,该元素属于____ (填“d”或“ds”)区。
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈____ 形,是_____ (填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个_____ 和3个____ 。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,____ (补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。
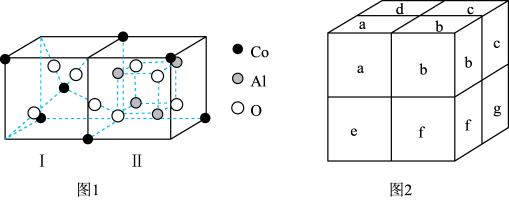
①图2中Ⅱ型小立方体分别是b、____ (填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=____ 。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是
 。
。(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=
您最近一年使用:0次
2022-04-09更新
|
720次组卷
|
5卷引用:湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题
湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市东城区2022届高三一模化学试题(已下线)【奋进985】08-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(广东专用)(已下线)化学-2022年高考押题预测卷03(北京卷)
名校
解题方法
2 . 氮、铁、钴等元素的化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)铁、钴位于周期表的_______ 区, 的电子式为
的电子式为_______ ,N、C、O的第一电离能由大到小的顺序为_______ , 中心离子的电子排布式为
中心离子的电子排布式为_______ ,已知 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测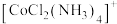 的空间结构有
的空间结构有_______ 种。
(2)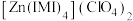 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为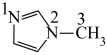 ,IMI中大π键可表示为
,IMI中大π键可表示为
_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号),配位数为_______ ,IMI的某种衍生物与甘氨酸形成的离子化合物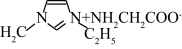 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是_______ 。
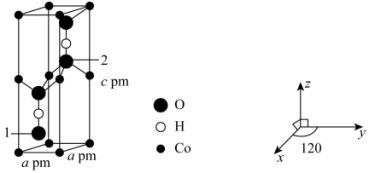
(3)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为_______ 。设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为_______  (用代数式表示)。
(用代数式表示)。
(1)铁、钴位于周期表的
 的电子式为
的电子式为 中心离子的电子排布式为
中心离子的电子排布式为 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测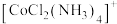 的空间结构有
的空间结构有(2)
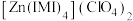 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,IMI中大π键可表示为
,IMI中大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为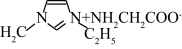 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是(3)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
名校
解题方法
3 . 第VA族的氮、磷、砷等在化合物中常表现出多种氧化态,在科研和生产中有着重要的用途。请回答以下问题。
(1)氮、磷、砷三种元素中,在元素周期表中紧邻金属和非金属分界线的为_______ (用元素符号表示),其价电子的轨道表示式为_______ 。
(2)氮的最高价氧化物对应的水化物中,第一电离能最大的元素为_______ (用元素符号表示);P能够形成PCl3和PCl5,而N只能形成NCl3,其原因为_______ 。
(3)①H3PO4的结构为 ,从结构角度对比其与H2SO4的酸性强弱,并解释原因:
,从结构角度对比其与H2SO4的酸性强弱,并解释原因:_______ 。
②五个磷酸分子的羟基之间脱去四个水分子形成五聚磷酸,则1 mol五聚磷酸分子中P-O键的物质的量为_______ mol。
③PH4I是治疗眼科疾病的常用药品,其阳离子的空间构型是_______ ,中心原子的杂化方式为_______ ,PH4I 中存在_______ (填标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
(4)红镍矿的主要成分为砷化镍(NiAs),NiAs的晶胞如图所示。每个晶胞含有_______ 个Ni原子。若每个晶胞的体积为a nm3,其晶胞密度为_______ g·cm-3(用含a的式子表示,NA为阿伏加德罗常数的值)。

(1)氮、磷、砷三种元素中,在元素周期表中紧邻金属和非金属分界线的为
(2)氮的最高价氧化物对应的水化物中,第一电离能最大的元素为
(3)①H3PO4的结构为
 ,从结构角度对比其与H2SO4的酸性强弱,并解释原因:
,从结构角度对比其与H2SO4的酸性强弱,并解释原因:②五个磷酸分子的羟基之间脱去四个水分子形成五聚磷酸,则1 mol五聚磷酸分子中P-O键的物质的量为
③PH4I是治疗眼科疾病的常用药品,其阳离子的空间构型是
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
(4)红镍矿的主要成分为砷化镍(NiAs),NiAs的晶胞如图所示。每个晶胞含有

您最近一年使用:0次
解题方法
4 . VA族元素及其化合物在生产、生活中用途广泛。
(1)① 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是______ 。
② 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为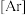
______ ,有______ 个未成对电子。
③P、S、 电负性由大到小的顺序是
电负性由大到小的顺序是______ 。
(2) 、
、 、
、 中沸点最高的是
中沸点最高的是______ ,其主要原因是______ 。
(3)①白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为______ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为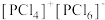 和
和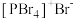 ,分析PCl5和PBr5结构存在差异的原因是
,分析PCl5和PBr5结构存在差异的原因是______ 。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm, ,则:
,则:
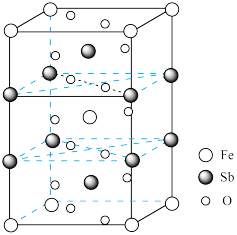
①锑酸亚铁的化学式为______ 。
②晶体的密度为______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)①
 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是②
 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为
③P、S、
 电负性由大到小的顺序是
电负性由大到小的顺序是(2)
 、
、 、
、 中沸点最高的是
中沸点最高的是(3)①白磷在氯气中燃烧可以得到
 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为
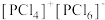 和
和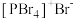 ,分析PCl5和PBr5结构存在差异的原因是
,分析PCl5和PBr5结构存在差异的原因是(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,
 ,则:
,则:
①锑酸亚铁的化学式为
②晶体的密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2021-01-25更新
|
1480次组卷
|
5卷引用:湖南省2021年普通高中学业水平选择考适应性测试化学试题
湖南省2021年普通高中学业水平选择考适应性测试化学试题广西名校大联考2022届高三上学期第一次大联考(入学摸底考试)化学试题(已下线)第4周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)02 物质结构与性质综合题型集训(2) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
5 . Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____ (填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6的结构式为_____ ;(标出配位键)其中 Al 的配位数为_________ 。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____ 种。
(4)Co2+的价电子排布式_________ 。NH3分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____ (填“较大”,“较小”或“相同”),解释原因_____ 。
(5)已知 CrO5中铬元素为最高价态,画出其结构式:_____ 。
(6)阿伏加 德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____ 。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加 德罗常数 NA=_____ mol-1(列计算式表达)。

(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6的结构式为
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有
(4)Co2+的价电子排布式
(5)已知 CrO5中铬元素为最高价态,画出其结构式:
(6)阿伏加 德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置

您最近一年使用:0次
2020-04-01更新
|
335次组卷
|
2卷引用:湖南名校大联考2020届高三第三次模拟考试卷化学试题
名校
6 . 铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________ (填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________ ;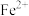 的核外电子排布式为
的核外电子排布式为_____________________ 。
(2)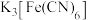 溶液可用于检验
溶液可用于检验_________ (填离子符号);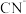 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为_____ ;1mol 含有的π键数目为
含有的π键数目为_______ (用N表示);C、N、O第一电离能由大到小的顺序为_________ (用元素符号表示)。
(3)某M原子的外围电子排布式为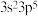 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
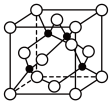
①该晶体的化学式为__________________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________ (填“离子”或“共价”)化合物。
③已知该晶体的密度为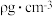 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为____________________ pm(只需写出计算式)。
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
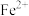 的核外电子排布式为
的核外电子排布式为(2)
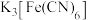 溶液可用于检验
溶液可用于检验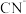 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为 含有的π键数目为
含有的π键数目为(3)某M原子的外围电子排布式为
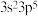 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为
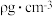 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
2019-04-26更新
|
567次组卷
|
4卷引用:【市级联考】湖南省怀化市2019届高三下学期4月第二次模拟考试理科综合化学试题
名校
解题方法
7 . 甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____ ,其核外电子共占据_____ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____ ,其组成元素的电负性由小到大的顺序为________ .
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________ ;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________ 。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
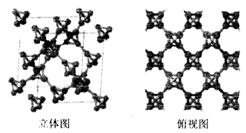
①T-碳与金刚石互称为_________ ;一个T-碳晶胞中含有______ 个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石晶胞的边长之比为________ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。

①T-碳与金刚石互称为
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石晶胞的边长之比为
您最近一年使用:0次
2018-03-27更新
|
408次组卷
|
3卷引用:湖南省长沙市长郡中学2022届高三上学期第一次月考化学试题
名校
解题方法
8 . 【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为_______ ;As原子的核外电子排布式为______________ 。
(2)NH3的沸点比PH3_____ (填“高"或“低”),原因是_____________ 。
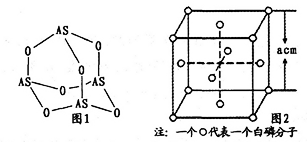
(3)Na3AsO4 中含有的化学键类型包括_______ ;AsO43-的空间构型为_______ ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________ 。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏伽德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______ ,该晶体的密度为___ g·cm-3(用含NA、a的式子表示)。

(1)N、P、As原子的第一电离能由大到小的顺序为
(2)NH3的沸点比PH3
(3)Na3AsO4 中含有的化学键类型包括
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏伽德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为
您最近一年使用:0次
2018-03-15更新
|
810次组卷
|
6卷引用:湖南师范大学附属中学2021-2022学年高三上学期第四次月考化学试题
名校
9 . 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为_____ ;
②此配离子中碳原子的杂化轨道类型为_____ ;
③此配离子中含有的化学键为_____ 。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____ 。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____ 。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____ (请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____ ,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____ nm(列计算式)。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为
②此配离子中碳原子的杂化轨道类型为
③此配离子中含有的化学键为
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为
您最近一年使用:0次
2018-01-25更新
|
714次组卷
|
5卷引用:【全国百强校】湖南省长沙市第一中学2019届高三下学期第七次月考理科综合化学试题
名校
解题方法
10 . ⅣA族元素及其化合物在材料等方面有重要用途 回答下列问题:
回答下列问题:
(1)碳的一种单质的结构如图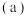 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为______
(2) 分子的立体构型为
分子的立体构型为______ ,属于______ 分子(填“极性”或“非极性”)
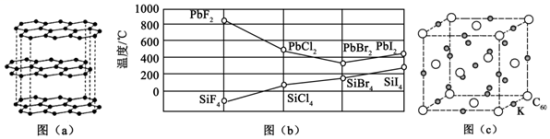
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.
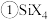 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是______
 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性______ (填“增强”“不变”或“减弱)
(4)碳的另一种单质 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图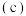 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为______ ,其晶胞参数为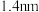 ,晶体密度为
,晶体密度为______  (列计算式)
(列计算式)
 回答下列问题:
回答下列问题:(1)碳的一种单质的结构如图
 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为
(2)
 分子的立体构型为
分子的立体构型为(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.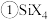 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性(4)碳的另一种单质
 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为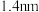 ,晶体密度为
,晶体密度为 (列计算式)
(列计算式)
您最近一年使用:0次
2018-05-01更新
|
312次组卷
|
2卷引用:2021年湖南省高考化学试卷变式题11-19



