名校
1 . 硒(Se)是人体健康必需的一种微量元素。已知 Se 的原子结构示意图为: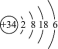 下列说法不正确的是
下列说法不正确的是
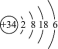 下列说法不正确的是
下列说法不正确的是| A.该元素处于第四周期第ⅥB 族 | B.SeO2既有氧化性又有还原性 |
| C.该原子的核电荷数为 34 | D.酸性:HBrO4 > H2SeO4 |
您最近一年使用:0次
2018-09-13更新
|
127次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
名校
2 . 短周期元素的离子:aW3+ 、bX+、 cY2-、 dZ-具有相同的电子层结构,下列关系中不正确的是( )
| A.质子数:c>d>b>a | B.还原性:Y2->Z- |
| C.氧化性:W3+ >X+ | D.半径:Y2->Z->X+>W3+ |
您最近一年使用:0次
2019-04-13更新
|
386次组卷
|
10卷引用:2015-2016学年湖南师大附中高一下第一次阶段测化学试卷
2015-2016学年湖南师大附中高一下第一次阶段测化学试卷2015-2016学年湖南师大附中高一下第一次段考化学试卷【全国百强校】湖南省衡阳市衡阳县第一中学2018-2019学年高一下学期第一次月考化学试题2015-2016学年江西省乐安一中高一下学期期中考试化学试卷山西省晋中市祁县第二中学校2018-2019学年高一下学期期中考试化学试题【市级联考】贵州省遵义市2018-2019学年高一下学期期中考试化学试题吉林省榆树一中2018-2019学年高一下学期期中考试化学试题(已下线)第5章 原子结构 元素周期律 单元测试(测)——2020年高考化学一轮复习讲练测新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
3 . 超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知: 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。

(1) 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是___________ (填标号)。
A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C. 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快
(2) 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。
①基态 的核外电子空间运动状态有
的核外电子空间运动状态有___________ 种。
② 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为___________ ,该晶体密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ pm。

(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠( )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。
①样品中铁元素的质量分数为___________ %。
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为___________ 。
已知:
 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
(1)
 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C.
 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快(2)
 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。①基态
 的核外电子空间运动状态有
的核外电子空间运动状态有②
 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为 ,则该晶胞的棱长为
,则该晶胞的棱长为
(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠(
 )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。①样品中铁元素的质量分数为
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为
您最近一年使用:0次
解题方法
4 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为[Ar]_____________ 。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是_______ ;醋酸钠中碳原子的杂化类型是_________ 。
(3)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛,化学共沉淀法是制备Fe3O4颗粒最常用的方法之一,方法是将FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,则该反应的离子方程式为______________ 。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
①晶胞中亚铁离子处于氧离子围成的___________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________ 。
③解释Fe3O4晶体能导电的原因:_________________________ ;若晶胞的体对角线长为a mm,则Fe3O4晶体的密度为________ (阿伏伽德罗常数用NA表示)g·cm—3
(1)基态铁原子的核外电子排布式为[Ar]
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是
(3)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛,化学共沉淀法是制备Fe3O4颗粒最常用的方法之一,方法是将FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,则该反应的离子方程式为
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因:
您最近一年使用:0次
名校
解题方法
5 . 硒酸铜晶体的分子式是CuSeO4•5H2O,淡蓝色晶体。有毒,能溶于水,微溶于丙酮,不溶于醇。80℃开始失水,150~220℃失去一个结晶水,265℃成为无水化合物。用于铜和铜合金着色,凯氏定氮催化剂,以及电子、仪表工业等。回答下列问题:
(1)铜元素位于元素周期表的____ ;基态Se原子的价电子排布式为____ ,基态Cu原子与基态Se原子核外未成对电子数之比为____ 。
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是____ (填化学式),S、Se、O电负性由大到小的顺序是____ 。
(3)硒酸铜中阴离子SeO 的空间结构为
的空间结构为____ 。在Cu的d轨道中电子排布成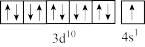 ,而不是
,而不是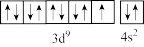 ,原因是
,原因是___ 。
(4)Cu2O熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。Cu2O的晶体类型是___ ,熔点Cu2O>Cu2S的原因是____ 。
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为___ ,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度为ρg•cm-3,设阿伏加德罗常数值为NA,则该晶胞的空间利用率为___ (用含π的式子表示)。

(1)铜元素位于元素周期表的
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是
(3)硒酸铜中阴离子SeO
 的空间结构为
的空间结构为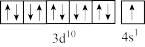 ,而不是
,而不是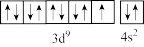 ,原因是
,原因是(4)Cu2O熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。Cu2O的晶体类型是
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为

您最近一年使用:0次
6 . 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2
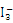 。
。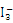 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 | 氟 | 氧 | 溴 | 碘 | 铍 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2

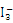 。
。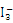 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。(6)写出一个ClO2-的等电子体:_________________。
您最近一年使用:0次



