名校
1 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
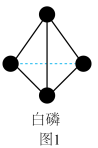
①白磷(P4)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③电负性:P___________ (填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
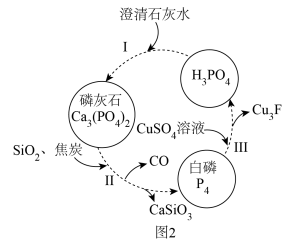
①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知:Cu3P不溶于水)。
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(P4)的相对分子质量为
②基态P原子中成对电子数与未成对电子数之比为
③电负性:P
(2)磷,及其部分重要化合物的相互转化如图2所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为
(3)反应Ⅲ的离子方程式为
您最近一年使用:0次
2024-01-10更新
|
140次组卷
|
2卷引用:辽宁省抚顺市六校协作体2023-2024学年高二上学期期末考试化学试题
解题方法
2 . 铜单质及其化合物在很多领域有重要的用途。
(1)铜单质属于_______ 晶体,铜晶胞如图I所示,一个铜晶胞含有_______ 个铜原子;铜和氧形成的一种离子化合物的晶体结构如图Ⅱ,则化合物中铜元素的化合价为_______ 。

(2)配合物 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是_______ (填化学式),配体是_______ (填化学式),配位数为_______ , 中的N
中的N_______ (填“给出”或“接受”)孤电子对。
(3) 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈_______ 形,n=_______ 。
(4) 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):

①乙二胺和三甲胺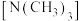 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:_______ 。
②配合物 中不存在的作用力类型有
中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
(1)铜单质属于

(2)配合物
 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是 中的N
中的N(3)
 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈(4)
 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):
①乙二胺和三甲胺
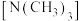 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:②配合物
 中不存在的作用力类型有
中不存在的作用力类型有A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
您最近一年使用:0次
解题方法
3 . 晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着它们具有不同的性质和用途。几种晶胞的结构示意图如下(石墨仅表示出其中的一层结构):

(1) 、金刚石和石墨三者的关系是互为
、金刚石和石墨三者的关系是互为___________ 。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时, 属于
属于___________ 晶体(填晶体类型)。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有Si-Si单键的数目是___________  。
。
(4)石墨层状结构中,碳原子数与C-C键数之比为___________ 。
(5)观察 分子晶体结构的一部分,试说明每个
分子晶体结构的一部分,试说明每个 分子周围有
分子周围有___________ 个与之紧邻且等距的 分子;该结构单元平均占有
分子;该结构单元平均占有___________ 个 分子。
分子。
(6)观察图形推测,CsCl晶体中每个 周围距离相等且最近的
周围距离相等且最近的 数目为
数目为___________ 个。

(1)
 、金刚石和石墨三者的关系是互为
、金刚石和石墨三者的关系是互为A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,
 属于
属于(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有Si-Si单键的数目是
 。
。(4)石墨层状结构中,碳原子数与C-C键数之比为
(5)观察
 分子晶体结构的一部分,试说明每个
分子晶体结构的一部分,试说明每个 分子周围有
分子周围有 分子;该结构单元平均占有
分子;该结构单元平均占有 分子。
分子。(6)观察图形推测,CsCl晶体中每个
 周围距离相等且最近的
周围距离相等且最近的 数目为
数目为
您最近一年使用:0次
2021-07-20更新
|
205次组卷
|
2卷引用:辽宁省丹东市2020-2021学年高二下学期期末教学质量监测化学试题
解题方法
4 . 铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__ ;Cr成为阳离子时首先失去__ 轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__ 。
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__ 。

(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__ (填元素符号);KSCN中阴离子的空间构型为___ 形,中心原子的杂化方式是__ 。
②分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为
键可表示为__ 。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。

①设NA为阿伏加 德罗常数的值,则CrO2的密度为__ (列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、( ,0,
,0, ),则原子坐标为(
),则原子坐标为(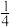 ,
,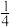 ,
,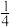 )和(
)和( ,
, ,
, )间的距离为
)间的距离为__ pm。
(1)基态Cr原子的价电子排布式为
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是

(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是
②分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为
键可表示为(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。

①设NA为阿伏加 德罗常数的值,则CrO2的密度为
②1、2号原子的坐标依次为(0,0,0)、(
 ,0,
,0, ),则原子坐标为(
),则原子坐标为(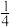 ,
,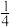 ,
,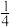 )和(
)和( ,
, ,
, )间的距离为
)间的距离为
您最近一年使用:0次
2020-06-12更新
|
264次组卷
|
2卷引用:辽宁省抚顺市2020届高三下学期420模拟(二模)考试理科综合化学试题
解题方法
5 . 铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__ 。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__ 。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__ 。(已知CO32-的结构式为 )
)
③NaNT可以 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为__ 。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___ 。晶胞中离1个Mn原子最近的Ni原子有__ 个。

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__ (列出计算表达式,NA表示阿伏加 德罗常数的数值)g•cm-3。

(1)基态Fe2+的核外电子排布式为
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 )
)③NaNT可以
 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为 中含有σ键的物质的量为
中含有σ键的物质的量为④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为

您最近一年使用:0次
名校
解题方法
6 . 国务院批复通过的《全国矿产资源规划(2016--2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子中核外电子占据的最高能级为__________ ,基态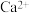 的最外层电子排布图为
的最外层电子排布图为_____________ 。
(2)萤石与浓硫酸反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因________________________ ,该反应涉及的元素的电负性由大到小的顺序______________________________ (用元素符号表示)。该反应的产物之一会与反应物继续反应生成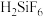 ,则
,则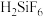 分子的中心原子价层电子对数为
分子的中心原子价层电子对数为____________ 。
(3) 分子中,O的杂化类型为
分子中,O的杂化类型为______________ , 分子VSEPR模型的名称为
分子VSEPR模型的名称为__________________ 。
(4)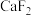 与
与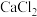 熔点比较高的物质是
熔点比较高的物质是____________ ,原因是___________________ 。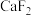 晶胞如图,其中F-的配位数为
晶胞如图,其中F-的配位数为________ 。在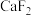 晶体中
晶体中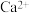 的离子半径为a cm,
的离子半径为a cm, 的离子半径为bcm;则
的离子半径为bcm;则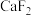 的密度为
的密度为___________  (设阿伏伽德罗常数的值为
(设阿伏伽德罗常数的值为 )。
)。

(1)基态F原子中核外电子占据的最高能级为
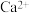 的最外层电子排布图为
的最外层电子排布图为(2)萤石与浓硫酸反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因
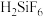 ,则
,则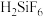 分子的中心原子价层电子对数为
分子的中心原子价层电子对数为(3)
 分子中,O的杂化类型为
分子中,O的杂化类型为 分子VSEPR模型的名称为
分子VSEPR模型的名称为(4)
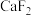 与
与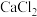 熔点比较高的物质是
熔点比较高的物质是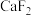 晶胞如图,其中F-的配位数为
晶胞如图,其中F-的配位数为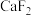 晶体中
晶体中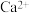 的离子半径为a cm,
的离子半径为a cm, 的离子半径为bcm;则
的离子半径为bcm;则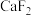 的密度为
的密度为 (设阿伏伽德罗常数的值为
(设阿伏伽德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
7 . N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________ 。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________ 。
(3)NH3分子的立体构型为_________ ,中心原子的杂化类型是_________ 。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________ ,电负性最小的是_________ 。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________ 。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
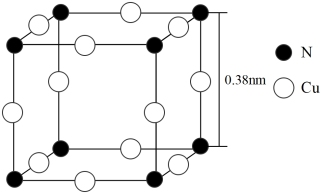
与每个Cu原子紧邻的Cu原子有_________ 个,阿伏伽德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
(1)基态铜原子的价电子排布式为
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是
(3)NH3分子的立体构型为
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为
(6)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有
您最近一年使用:0次
2019-01-05更新
|
496次组卷
|
4卷引用:辽宁省营口市高级中学2020届高三下学期3月月考理综化学试题
名校
8 . 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为_____ ;
②此配离子中碳原子的杂化轨道类型为_____ ;
③此配离子中含有的化学键为_____ 。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____ 。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____ 。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____ (请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____ ,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____ nm(列计算式)。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为
②此配离子中碳原子的杂化轨道类型为
③此配离子中含有的化学键为
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为
您最近一年使用:0次
2018-01-25更新
|
714次组卷
|
5卷引用:辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题
9 . 过渡金属元素的单质及化合物在科学研究和工业生产中具有许多用途,根据所学知识回答下列问题:
(1)基态Ni2+的核外电子排布式_______________ ;配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,固态Ni(CO)4,属于_______________ 晶体;镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的价电子排布为3d10,则其杂化轨道类型为_______________ ,Ni(CO)4是_______________ (填“极性”或“非极性” )分子。
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为_______________ ;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含_______________ 个配位键。

(3)铜能与类卤素(SCN)2 反应生成 Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为__________ ; 类卤素 (SCN)2 对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______________ 。
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为_______________ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。

人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为_______________ 。

(1)基态Ni2+的核外电子排布式
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为

(3)铜能与类卤素(SCN)2 反应生成 Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为

人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为

您最近一年使用:0次
2017-06-10更新
|
524次组卷
|
2卷引用:辽宁省葫芦岛协作体2017届高三下学期模拟考试(6月)化学试卷



