解题方法
1 . 氯化铍(BeO)高温下导热性能良好,具有一定的防核辐射作用,常用于制合金、催化剂和耐火材料等。利用金绿宝石共生矿(主要成分是BeAl2O4,含少量铁的氧化物、石英)制备氧化铍和副产品铵明矾 的工艺流程如下:
的工艺流程如下:

已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“熔炼”的作用是___________ 。
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:___________ 。①充分反应,提高浸出率;②____________ 。
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:
__________ ↑+__________  。
。
(4)“氧化”时加入H2O2的目的是___________ 。“调pH”的范围是________ 。
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为_______________ 。
②若晶胞参数为anm,设阿伏加德罗常数的值为 ,则BeO晶体的密度
,则BeO晶体的密度
________ g·cm-3。
 的工艺流程如下:
的工艺流程如下:
已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Be2+ |
| 开始沉淀pH | 1.5 | 3.3 | 6.5 | 5.2 |
| 完全沉淀pH | 3.7 | 5.0 | 9.7 | 8.8 |
(1)“熔炼”的作用是
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:

 。
。(4)“氧化”时加入H2O2的目的是
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为
②若晶胞参数为anm,设阿伏加德罗常数的值为
 ,则BeO晶体的密度
,则BeO晶体的密度
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
①晶体中分子间作用力越大,分子越稳定
②共价晶体中共价键越强,熔点越高
③金属晶体的导电性、导热性均与自由电子有关
④正四面体构型的分子,键角都是109°28′,其晶体类型可能是共价晶体或分子晶体
⑤分子晶体中都含有化学键
⑥4.8g金刚石晶体中碳碳键的数目为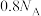
⑦在晶体中只要有阳离子就一定有阴离子
⑧晶体状态下能导电的一定是金属晶体
①晶体中分子间作用力越大,分子越稳定
②共价晶体中共价键越强,熔点越高
③金属晶体的导电性、导热性均与自由电子有关
④正四面体构型的分子,键角都是109°28′,其晶体类型可能是共价晶体或分子晶体
⑤分子晶体中都含有化学键
⑥4.8g金刚石晶体中碳碳键的数目为
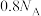
⑦在晶体中只要有阳离子就一定有阴离子
⑧晶体状态下能导电的一定是金属晶体
| A.④⑥⑦ | B.②③⑥ | C.①③⑤ | D.④⑤⑧ |
您最近一年使用:0次
3 . a、b、c、d、e为前四周期元素(除稀有气体),原子序数依次增大。a的基态原子价电子层有3个未成对电子;b元素常见的盐可用于纺织、制皂、制玻璃和焙制糕点;c元素的盐类大多具有硬度高、熔点高、难溶于水、化学性质稳定等特点;d元素原子在同周期元素中原子半径最小;e元素在地壳中的含量排在第四位;回答下列问题:
(1)在一定条件下,a的简单氢化物与其正四价的氧化物可转化为 ,每生成1mol
,每生成1mol 时转移
时转移___________ mol电子;汽车安全气囊中含有 ,受撞击使分解产生b单质和
,受撞击使分解产生b单质和 ,若产生40.32L(标准状况下)
,若产生40.32L(标准状况下) ,至少需要
,至少需要
___________ g。
(2)将一定量 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为___________ 。
(3)c元素的氧化物中c原子的杂化方式___________ 。
(4)c元素与d形成化合物 ,
, 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为___________ 。
(5)d元素形成的单质在强碱性环境下能将e元素的红褐色难溶碱氧化成+6价的含氧酸根,写出离子方程式___________ 。
(1)在一定条件下,a的简单氢化物与其正四价的氧化物可转化为
 ,每生成1mol
,每生成1mol 时转移
时转移 ,受撞击使分解产生b单质和
,受撞击使分解产生b单质和 ,若产生40.32L(标准状况下)
,若产生40.32L(标准状况下) ,至少需要
,至少需要
(2)将一定量
 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为(3)c元素的氧化物中c原子的杂化方式
(4)c元素与d形成化合物
 ,
, 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为(5)d元素形成的单质在强碱性环境下能将e元素的红褐色难溶碱氧化成+6价的含氧酸根,写出离子方程式
您最近一年使用:0次
解题方法
4 . 2022年北京冬季奥运会场馆使用了大量不锈钢材质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬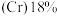 、含镍
、含镍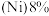 。回答下列问题:
。回答下列问题:
(1)不锈钢所属的晶体类型为_______ 。
(2)铁系元素能与 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点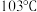 ,则该晶体的晶体类型为
,则该晶体的晶体类型为_______ 晶体, 中含有的化学键类型包括
中含有的化学键类型包括_______ (填字母)。
A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与 可形成低价态氧化物
可形成低价态氧化物 。
。
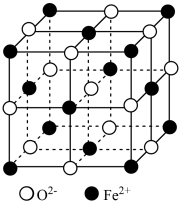
① 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为_______ ;与 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为_______ 。
②若 与
与 之间最近距离为
之间最近距离为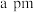 ,则该晶体的密度计算式为
,则该晶体的密度计算式为_______  。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
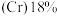 、含镍
、含镍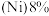 。回答下列问题:
。回答下列问题:(1)不锈钢所属的晶体类型为
(2)铁系元素能与
 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点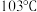 ,则该晶体的晶体类型为
,则该晶体的晶体类型为 中含有的化学键类型包括
中含有的化学键类型包括A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与
 可形成低价态氧化物
可形成低价态氧化物 。
。
①
 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为②若
 与
与 之间最近距离为
之间最近距离为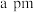 ,则该晶体的密度计算式为
,则该晶体的密度计算式为 。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
您最近一年使用:0次
名校
5 . 锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应: ,回答下列问题:
,回答下列问题:
(1)基态Zn的价电子排布式为_____ ,基态C原子核外电子占据_______ 个空间运动状态不同的原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为______ ,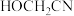 分子中含有的σ键与π键数目之比为
分子中含有的σ键与π键数目之比为________ 。
(3)HCHO分子中碳原子轨道的杂化类型是_______ ,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是______ 。
(4) 中
中 与
与 之间的化学键称为
之间的化学键称为_____ ,提供孤电子对的成键原子是______ 。
(5)Zn与S形成某种化合物的晶胞如图所示。

① 填入
填入 组成的
组成的_______ 空隙中;
A.四面体 B.六面体 C.八面体 D.十二面体
②已知晶体密度为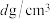 ,该晶胞的边长表达式为
,该晶胞的边长表达式为____ pm(写计算表达式)。
 ,回答下列问题:
,回答下列问题:(1)基态Zn的价电子排布式为
(2)C、N、O三种元素的第一电离能由大到小的顺序为
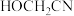 分子中含有的σ键与π键数目之比为
分子中含有的σ键与π键数目之比为(3)HCHO分子中碳原子轨道的杂化类型是
(4)
 中
中 与
与 之间的化学键称为
之间的化学键称为(5)Zn与S形成某种化合物的晶胞如图所示。

①
 填入
填入 组成的
组成的A.四面体 B.六面体 C.八面体 D.十二面体
②已知晶体密度为
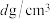 ,该晶胞的边长表达式为
,该晶胞的边长表达式为
您最近一年使用:0次
名校
解题方法
6 . B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有___________ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(2)硼的卤化物的沸点如表所示:
解释表中卤化物之间沸点差异的原因___________ 。
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为___________ ;Ni(PPh3)2晶体中存在的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++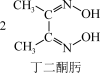

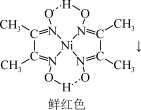 +2H+
+2H+
在1mol鲜红色沉淀中,含有sp2杂化原子的数目为___________ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为___________ (用元素符号表示)。
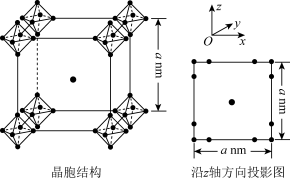
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=___________ g·cm-3。
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
解释表中卤化物之间沸点差异的原因
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++


 +2H+
+2H+在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
2021-07-23更新
|
454次组卷
|
3卷引用:辽宁省沈阳市第二中学2022-2023学年高三上学期期中考试化学试题
7 . 第三周期主族元素W、X、Y、Z的最高化合价与该元素的原子半径的关系如图所示。

回答下列问题:
(1)W和Z组成W2Z2晶体中所含化学键为___________ ,该晶体类型是___________ 。
(2)XY3的分子式为___________ ,该分子的立体构型是___________ ,中心原子的杂化方式是___________ 。
(3)W和Y组成晶体的晶胞如图1所示,晶胞截面如图2所示。已知:晶体密度为 ,
, 代表阿伏加德罗常数的值,Y对应的离子半径为
代表阿伏加德罗常数的值,Y对应的离子半径为 。则W的离子半径为
。则W的离子半径为___________ 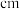 。
。
(4)W单质晶体的晶胞如图3所示。
①晶胞中等距离且最近的W原子有___________ 个。
②若W的半径为bnm,则该晶体密度为___________  。
。

回答下列问题:
(1)W和Z组成W2Z2晶体中所含化学键为
(2)XY3的分子式为
(3)W和Y组成晶体的晶胞如图1所示,晶胞截面如图2所示。已知:晶体密度为
 ,
, 代表阿伏加德罗常数的值,Y对应的离子半径为
代表阿伏加德罗常数的值,Y对应的离子半径为 。则W的离子半径为
。则W的离子半径为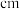 。
。
(4)W单质晶体的晶胞如图3所示。
①晶胞中等距离且最近的W原子有
②若W的半径为bnm,则该晶体密度为
 。
。
您最近一年使用:0次
2021-07-08更新
|
240次组卷
|
5卷引用:辽宁省朝阳市凌源市2021-2022学年高二下学期期中联考化学试题
名校
8 . 三价铬离子( )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3) 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为_______
(4)化学式为 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为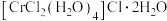 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为 ,晶体密度为
,晶体密度为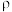
 ,则该晶胞的棱长为
,则该晶胞的棱长为_______ pm。

 )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:(1)Cr的价层电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)
 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为(4)化学式为
 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为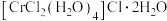 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为
 ,晶体密度为
,晶体密度为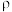
 ,则该晶胞的棱长为
,则该晶胞的棱长为
您最近一年使用:0次
2021-06-15更新
|
136次组卷
|
2卷引用:辽宁省阜新二高2020-2021学年高二下学期期中考试化学试题
9 . 铝是地壳中含量最丰富的金属元素。铝及其化合物在航空、建筑、汽车等工业领域有着重要的应用。工业上以冰晶石为助熔剂电解熔融氧化铝冶炼铝。请根据物质结构与性质的相关知识回答下列问题:

(1) 化学键中离子键的百分数为41%,则
化学键中离子键的百分数为41%,则 应作为
应作为___________ 晶体(填晶体类型)来处理。
(2)冰晶石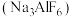 能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“
能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“ ”所代表的微粒是
”所代表的微粒是___________ 。
(3)氯化铝的熔点为194℃,易升华,氯化铝属于___________ 晶体(填晶体类型)。氯化铝常以二聚体的形式存在其结构模型为 ,一个二聚体中含有配位键
,一个二聚体中含有配位键___________ 个,铝原子的杂化方式为___________ 。
(4) 在一定条件下可制得熔点和硬度都很高的
在一定条件下可制得熔点和硬度都很高的 晶体,晶胞结构如图乙所示,则一个晶胞中含有
晶体,晶胞结构如图乙所示,则一个晶胞中含有___________ 个N原子, 的配位数为
的配位数为___________ 。
(5)金属铝的晶胞如图丙所示:晶胞边长为 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。

(1)
 化学键中离子键的百分数为41%,则
化学键中离子键的百分数为41%,则 应作为
应作为(2)冰晶石
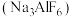 能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“
能电离产生两种离子,晶体结构如图甲,“●”位于顶点和面心,“○”位于棱的中点和小立方体的体心,则大立方体的体心“ ”所代表的微粒是
”所代表的微粒是(3)氯化铝的熔点为194℃,易升华,氯化铝属于
 ,一个二聚体中含有配位键
,一个二聚体中含有配位键(4)
 在一定条件下可制得熔点和硬度都很高的
在一定条件下可制得熔点和硬度都很高的 晶体,晶胞结构如图乙所示,则一个晶胞中含有
晶体,晶胞结构如图乙所示,则一个晶胞中含有 的配位数为
的配位数为(5)金属铝的晶胞如图丙所示:晶胞边长为
 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
解题方法
10 . 快离子导体是一类具有优良离子导电能力的固体电解质,研究得最多的是Ag、Cu、Li、Na、F、O等的快离子导体。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中_________ 轨道上的电子。
(2)N、O、F的第一电离能从小到大的顺序为_________ (用元素符号表示);NH3、H2O、HF的沸点由低到高的顺序为_________ (用化学式表示,下同),其中NH3、H2O的键角由小到大的顺序为_________ 。
(3)4HF+H3BO3=HBF4+3H2O,HBF4在水溶液中发生电离HBF4=H++ ,其中
,其中 的空间构型为
的空间构型为_________ ,其中B的杂化类型为_________ 。
(4)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图1,1mol该配合物中所含的配位键为_________ mol。
(5)Li3SBF4是潜在的快离子导体,其晶胞结构如图2,A原子的坐标为_________ ;设阿伏加德罗常数的值为NA,晶胞边长为anm,则晶胞密度为_________ (列出计算式)g·cm-3。若在运算建立该晶体的模型过程中,晶胞中部分BF4-被Cl-取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为_________ 。

(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中
(2)N、O、F的第一电离能从小到大的顺序为
(3)4HF+H3BO3=HBF4+3H2O,HBF4在水溶液中发生电离HBF4=H++
 ,其中
,其中 的空间构型为
的空间构型为(4)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图1,1mol该配合物中所含的配位键为


(5)Li3SBF4是潜在的快离子导体,其晶胞结构如图2,A原子的坐标为

您最近一年使用:0次



