安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
全国
高二
期末
2021-07-16
362次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学
安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
全国
高二
期末
2021-07-16
362次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 2020年12月17日,嫦娥五号返回舱携带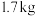 月壤成功着陆,月壤中富含
月壤成功着陆,月壤中富含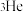 。下列有关说法错误的是
。下列有关说法错误的是
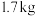 月壤成功着陆,月壤中富含
月壤成功着陆,月壤中富含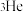 。下列有关说法错误的是
。下列有关说法错误的是A.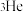 、 、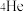 互为同位素 互为同位素 | B. 属于化学反应 属于化学反应 |
C.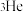 原子中电子数与中子数之差为 原子中电子数与中子数之差为 | D.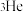 和 和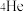 的核外电子排布均为 的核外电子排布均为 |
您最近一年使用:0次
2021-07-08更新
|
114次组卷
|
3卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
单选题
|
适中(0.65)
解题方法
2. 下列是某些元素的最外层电子排布,各组指定的元素中能形成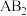 型离子化合物的是
型离子化合物的是
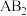 型离子化合物的是
型离子化合物的是A.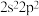 和 和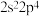 | B.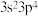 和 和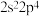 |
C. 和 和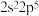 | D.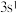 和 和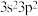 |
【知识点】 离子键 电子排布式解读 离子化合物的结构特征与性质解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
3. 下列对电子排布式或轨道表示式书写的评价正确的是
| 选项 | 电子排布式或轨道表示式 | 评价 |
| A | N原子的轨道表示式: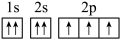 | 错误;违反洪特规则 |
| B | O原子的轨道表示式: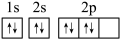 | 错误;违反泡利不相容原理 |
| C | K原子的轨道表示式: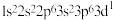 | 错误;违反能量最低原理 |
| D |  的电子排布式: 的电子排布式: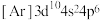 | 错误;违反能量最低原理 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-15更新
|
1768次组卷
|
13卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测四川省内江市第六中学2021-2022学年高二上学期第一次月考化学试题(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖南省长沙市周南中学2021-2022学年高二上学期(12月)第三次阶段检测卷化学试题新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(加强班)河北省石家庄市河北正中实验中学2022-2023学年高二上学期10月月考化学试题河北省衡水市第二中学2022-2023学年高二上学期期中考试化学试题黑龙江省肇东市第四中学2022-2023学年高二上学期期末考试化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题广东省东莞实验中学2022-2023学年高二上学期第一次月考化学试题广东省东莞市第十高级中学2023-2024学年高二上学期第一次段考化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 我国航天探测发现,金星是一个被浓密大气层包围的固体球,大气层的主要成分之一是三氧化二碳(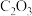 )。下列关于
)。下列关于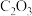 。的说法正确的是
。的说法正确的是
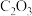 )。下列关于
)。下列关于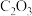 。的说法正确的是
。的说法正确的是A.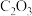 属于离子化合物 属于离子化合物 | B.最高化合价: |
C.原子未成对电子数: | D.第一电离能: |
您最近一年使用:0次
2021-07-15更新
|
115次组卷
|
2卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
单选题
|
适中(0.65)
解题方法
5. 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,已知X、Z的原子核外电子数之和等于Y的核外电子数。下列判断正确的是
| X | W | Z |
| Y |
A.最高价氧化物对应水化物的酸性: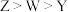 |
B.简单氢化物的稳定性: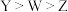 |
C.电负性: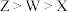 |
D.简单离子半径: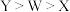 |
您最近一年使用:0次
单选题
|
适中(0.65)
6. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法中不正确的是


A.电负性: |
B.原子半径: |
| C.B和E处于第ⅦA族 |
| D.由A和C形成的化合物中可能含有共价键 |
【知识点】 根据原子结构进行元素种类推断解读 共价键 电负性
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 已知X、Y是短周期主族元素,I为电离能,单位是 。根据下表所列数据判断下列说法正确的是
。根据下表所列数据判断下列说法正确的是
 。根据下表所列数据判断下列说法正确的是
。根据下表所列数据判断下列说法正确的是| 元素 |  |  |  |  |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是 |
| B.元素Y是第ⅡA族元素 |
| C.同周期主族元素中,X的第一电离能最小 |
| D.元素Y的单质可与冷水剧烈反应 |
【知识点】 由元素性质的递变规律进行相关推断解读 电离能 电离能变化规律解读
您最近一年使用:0次
2021-07-15更新
|
218次组卷
|
5卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
单选题
|
较易(0.85)
解题方法
8.  是重要的化工原料,其制备反应为
是重要的化工原料,其制备反应为 。下列有关说法不正确的是
。下列有关说法不正确的是
 是重要的化工原料,其制备反应为
是重要的化工原料,其制备反应为 。下列有关说法不正确的是
。下列有关说法不正确的是A. 的电子式为 的电子式为 |
B. 属于金属晶体 属于金属晶体 |
C. 为直线型非极性分子 为直线型非极性分子 |
D. 属于离子晶体 属于离子晶体 |
您最近一年使用:0次
2021-07-15更新
|
127次组卷
|
2卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
单选题
|
较易(0.85)
名校
解题方法
10. 钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法错误的是


| A.该晶体属于离子晶体 |
B.晶体的化学式为 |
C.该晶体晶胞结构与 相似 相似 |
D.与每个 距离最近且相等的 距离最近且相等的 共有3个 共有3个 |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读 离子晶体
您最近一年使用:0次
2021-07-15更新
|
343次组卷
|
5卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
单选题
|
适中(0.65)
11. 甲胺铅碘( )是新型太阳能电池的敏化剂,其合成原料为
)是新型太阳能电池的敏化剂,其合成原料为 、
、 及
及 。下列说法正确的是
。下列说法正确的是
 )是新型太阳能电池的敏化剂,其合成原料为
)是新型太阳能电池的敏化剂,其合成原料为 、
、 及
及 。下列说法正确的是
。下列说法正确的是A. 为非极性分子 为非极性分子 |
B. 分子间可形成氢键 分子间可形成氢键 |
C. 分子中氮原子的杂化轨道类型为 分子中氮原子的杂化轨道类型为 |
D.质子数为82,中子数为125的 原子可表示为 原子可表示为 |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
12. 实验室用 检验
检验 的离子方程式为
的离子方程式为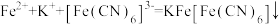 。下列有关说法正确的是
。下列有关说法正确的是
 检验
检验 的离子方程式为
的离子方程式为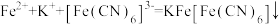 。下列有关说法正确的是
。下列有关说法正确的是A. 中铁离子的配位数为3 中铁离子的配位数为3 |
B.  含 含  键 键 |
C.形成配位键时, 中氮原子提供孤电子对 中氮原子提供孤电子对 |
D. 再失去1个电子比 再失去1个电子比 更难 更难 |
您最近一年使用:0次
2021-07-15更新
|
881次组卷
|
5卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
单选题
|
适中(0.65)
13. 据报道,我国科学家用激光技术将碳原子与氮原子结合成碳氮化合物薄膜。研究发现这种化合物的硬度比金刚石更大。其原因可能是
| A.氮原子电子数比碳原子电子数多 |
| B.碳氮化合物中形成了离子键 |
| C.碳、氮原子构成平面结构的晶体 |
| D.碳氮化合物晶体中碳氮键比金刚石中的碳碳键键长更短 |
【知识点】 微粒半径大小的比较方法解读 原子晶体(旧教材)
您最近一年使用:0次
2021-07-08更新
|
132次组卷
|
2卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
单选题
|
较易(0.85)
解题方法
14. 下列关于 和
和 的说法错误的是
的说法错误的是
 和
和 的说法错误的是
的说法错误的是| A.固态时两者均属于分子晶体 |
B. 分子中含有极性共价键是非极性分子 分子中含有极性共价键是非极性分子 |
C.因为碳氢键键能小于碳氧双键,所以 的熔点低于 的熔点低于 |
D. 和 和 分子中碳原子的杂化类型分别是 分子中碳原子的杂化类型分别是 和 和 |
您最近一年使用:0次
2021-07-08更新
|
253次组卷
|
4卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
广西北海市2020-2021学年高二下学期期末教学质量检测化学试题安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题(已下线)第3.2.1讲 分子晶体-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)3.2.1 分子晶体(巩固)
单选题
|
较易(0.85)
名校
15. 观察下列模型并结合有关信息,判断下列说法错误的是
| 物质或结构单元 | 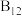 |  |  |  |
| 结构模型示意图 |
|
|
|
|
| 备注 | 熔点1873K | — | 易溶于 | — |
| A.单质硼属于原子晶体 |
B. 是非极性分子 是非极性分子 |
C. 属于分子晶体 属于分子晶体 |
D. 分子中 分子中 键与 键与 键的数目之比为 键的数目之比为 |
【知识点】 极性分子和非极性分子解读 原子晶体(旧教材)
您最近一年使用:0次
2021-07-15更新
|
307次组卷
|
4卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
二、填空题 添加题型下试题
填空题
|
较易(0.85)
16. 近期我国科研工作者研究的金属—氮—碳优异电催化 还原催化剂取得新进展。回答下列问题:
还原催化剂取得新进展。回答下列问题:
(1)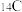 可用于考古,其中子数为
可用于考古,其中子数为___________ ,该基态原子价层电子轨道表示式为___________ 。
(2)研究发现钴—氮—碳优异电催化 还原催化剂活性最高,金属钴的核外电子排布式为
还原催化剂活性最高,金属钴的核外电子排布式为___________ ;基态 未成对电子数为
未成对电子数为___________ 。
(3)基态N原子中,电子占据的最高能层符号为___________ ,该能层具有的原子轨道数为___________ ,电子数为___________ 。
 还原催化剂取得新进展。回答下列问题:
还原催化剂取得新进展。回答下列问题:(1)
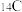 可用于考古,其中子数为
可用于考古,其中子数为(2)研究发现钴—氮—碳优异电催化
 还原催化剂活性最高,金属钴的核外电子排布式为
还原催化剂活性最高,金属钴的核外电子排布式为 未成对电子数为
未成对电子数为(3)基态N原子中,电子占据的最高能层符号为
【知识点】 基态核外电子排布规律 电子排布式解读 轨道表示式解读
您最近一年使用:0次
2021-07-15更新
|
362次组卷
|
3卷引用:安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题
安徽省、河南省皖豫联盟体2020-2021学年高二下学期期末联合调研化学试题(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)贵州省石阡县民族中学2022-2023学年高二下学期3月月考化学试题
填空题
|
较易(0.85)
解题方法
17. 科学研究发现甲醇( )、炭基硫(
)、炭基硫( ,与
,与 互为等电子体)是火星上存在的有机物。
互为等电子体)是火星上存在的有机物。
回答下列问题:
(1) 中C的杂化类型为
中C的杂化类型为___________ 。
(2)
 中含有
中含有___________ 
 键。
键。
(3) 分子中键长:
分子中键长:
___________ (填“>”或“<”,下同)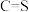 ,键能
,键能
___________ 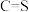 ;
; 键与
键与 键间的夹角为
键间的夹角为___________ ; 分子属于
分子属于___________ (填“极性”域“非极性”)分子。
(4)与 互为等电子体的阴离子有
互为等电子体的阴离子有___________ (列举一种)。
 )、炭基硫(
)、炭基硫( ,与
,与 互为等电子体)是火星上存在的有机物。
互为等电子体)是火星上存在的有机物。回答下列问题:
(1)
 中C的杂化类型为
中C的杂化类型为(2)

 中含有
中含有
 键。
键。(3)
 分子中键长:
分子中键长:
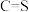 ,键能
,键能
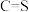 ;
; 键与
键与 键间的夹角为
键间的夹角为 分子属于
分子属于(4)与
 互为等电子体的阴离子有
互为等电子体的阴离子有
您最近一年使用:0次
填空题
|
较易(0.85)
18. C、 为第ⅣA族短周期元素,
为第ⅣA族短周期元素, 和
和 的化学式相似,但结构和物理性质有很大的不同。
的化学式相似,但结构和物理性质有很大的不同。
回答下列问题:
(1) 、CO2两种晶体的构成微粒分别是
、CO2两种晶体的构成微粒分别是___________ 、___________ (填“原子”或“分子”),熔化时克服的微粒间的作用力分别是___________ 、___________ 。
(2) 属于
属于___________ 晶体,干冰属于___________ 晶体,熔点:
___________ (填“>”“<”或“=”)干冰。
(3)从原子半径大小的角度分析,C、O原子间能形成 键,而
键,而 、O原子间不能形成
、O原子间不能形成 键的原因是
键的原因是___________ 。
 为第ⅣA族短周期元素,
为第ⅣA族短周期元素, 和
和 的化学式相似,但结构和物理性质有很大的不同。
的化学式相似,但结构和物理性质有很大的不同。回答下列问题:
(1)
 、CO2两种晶体的构成微粒分别是
、CO2两种晶体的构成微粒分别是(2)
 属于
属于
(3)从原子半径大小的角度分析,C、O原子间能形成
 键,而
键,而 、O原子间不能形成
、O原子间不能形成 键的原因是
键的原因是
您最近一年使用:0次
三、解答题 添加题型下试题
19. 前四周期元素A、B、C、D、E的原子序数依次增大。A的负一价阴离子与 电子层结构相同,B的电负性比D的大,B和D位于不同主族。C元素原子的最外层电子数比次外层电子数少5;基态D原子的价层电子排布式为
电子层结构相同,B的电负性比D的大,B和D位于不同主族。C元素原子的最外层电子数比次外层电子数少5;基态D原子的价层电子排布式为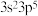 ,基态E原子的未成对电子数为6.回答下列问题:
,基态E原子的未成对电子数为6.回答下列问题:
(1)基态E原子的电子排布式为
___________ 。
(2) 和
和 的晶体类型都是
的晶体类型都是___________ ,熔点、沸点:
___________ (填“高于”“低于”或“等于”) 的,原因是
的,原因是___________ 。
(3)D有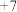 、
、 、
、 、
、 价,其对应含氧酸的酸性由弱到强的顺序为
价,其对应含氧酸的酸性由弱到强的顺序为___________ (填化学式)。
(4)B、E组成一种晶体M,晶胞如图所示。小黑球代表B,小白球代表E,M的化学式为___________ 。

 电子层结构相同,B的电负性比D的大,B和D位于不同主族。C元素原子的最外层电子数比次外层电子数少5;基态D原子的价层电子排布式为
电子层结构相同,B的电负性比D的大,B和D位于不同主族。C元素原子的最外层电子数比次外层电子数少5;基态D原子的价层电子排布式为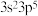 ,基态E原子的未成对电子数为6.回答下列问题:
,基态E原子的未成对电子数为6.回答下列问题:(1)基态E原子的电子排布式为

(2)
 和
和 的晶体类型都是
的晶体类型都是
 的,原因是
的,原因是(3)D有
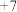 、
、 、
、 、
、 价,其对应含氧酸的酸性由弱到强的顺序为
价,其对应含氧酸的酸性由弱到强的顺序为(4)B、E组成一种晶体M,晶胞如图所示。小黑球代表B,小白球代表E,M的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
20. 第三周期主族元素W、X、Y、Z的最高化合价与该元素的原子半径的关系如图所示。

回答下列问题:
(1)W和Z组成W2Z2晶体中所含化学键为___________ ,该晶体类型是___________ 。
(2)XY3的分子式为___________ ,该分子的立体构型是___________ ,中心原子的杂化方式是___________ 。
(3)W和Y组成晶体的晶胞如图1所示,晶胞截面如图2所示。已知:晶体密度为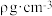 ,
,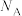 代表阿伏加德罗常数的值,Y对应的离子半径为
代表阿伏加德罗常数的值,Y对应的离子半径为 。则W的离子半径为
。则W的离子半径为___________ 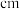 。
。
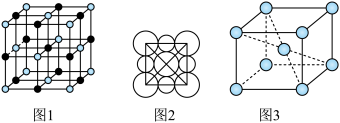
(4)W单质晶体的晶胞如图3所示。
①晶胞中等距离且最近的W原子有___________ 个。
②若W的半径为bnm,则该晶体密度为___________  。
。

回答下列问题:
(1)W和Z组成W2Z2晶体中所含化学键为
(2)XY3的分子式为
(3)W和Y组成晶体的晶胞如图1所示,晶胞截面如图2所示。已知:晶体密度为
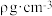 ,
,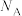 代表阿伏加德罗常数的值,Y对应的离子半径为
代表阿伏加德罗常数的值,Y对应的离子半径为 。则W的离子半径为
。则W的离子半径为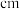 。
。
(4)W单质晶体的晶胞如图3所示。
①晶胞中等距离且最近的W原子有
②若W的半径为bnm,则该晶体密度为
 。
。
您最近一年使用:0次
2021-07-08更新
|
239次组卷
|
5卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
试卷分析
整体难度:适中
考查范围:物质结构与性质、认识化学科学
试卷题型(共 20题)
题型
数量
单选题
15
填空题
3
解答题
2
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 原子的构成 原子的基本构成 原子中相关数值及其之间的相互关系 元素、核素、同位素 | |
| 2 | 0.65 | 离子键 电子排布式 离子化合物的结构特征与性质 | |
| 3 | 0.65 | 核外电子能级分布 基态核外电子排布规律 能量最低原理 洪特规则 | |
| 4 | 0.65 | 电子排布式 电离能变化规律 离子化合物的结构特征与性质 | |
| 5 | 0.65 | 根据原子结构进行元素种类推断 “位构性”关系理解及应用 元素性质与电负性的关系 | |
| 6 | 0.65 | 根据原子结构进行元素种类推断 共价键 电负性 | |
| 7 | 0.65 | 由元素性质的递变规律进行相关推断 电离能 电离能变化规律 | |
| 8 | 0.85 | 共价型分子结构式、电子式 极性分子和非极性分子 金属晶体结构与性质 常见离子晶体的结构 | |
| 9 | 0.85 | 不同晶体的结构微粒及微粒间作用的区别 | |
| 10 | 0.85 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 离子晶体 | |
| 11 | 0.65 | 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 含有氢键的物质 | |
| 12 | 0.4 | 核外电子排布规律 配合物的概念、组成及形成条件 简单配合物的成键 | |
| 13 | 0.65 | 微粒半径大小的比较方法 原子晶体(旧教材) | |
| 14 | 0.85 | 分子的性质 利用杂化轨道理论判断化学键杂化类型 常见分子晶体的结构 | |
| 15 | 0.85 | 极性分子和非极性分子 原子晶体(旧教材) | |
| 二、填空题 | |||
| 16 | 0.85 | 基态核外电子排布规律 电子排布式 轨道表示式 | |
| 17 | 0.85 | 物质结构中化学键数目的计算 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 | |
| 18 | 0.85 | 晶体类型判断 离子晶体 晶体的类型与物质的性质的相互关系及应用 | |
| 三、解答题 | |||
| 19 | 0.65 | 根据原子结构进行元素种类推断 电子排布式 氢键对物质性质的影响 根据晶胞结构确定晶体化学式 | 结构与性质 |
| 20 | 0.65 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 不同晶体的结构微粒及微粒间作用的区别 | 结构与性质 |

 和
和
 和
和 和
和 和
和