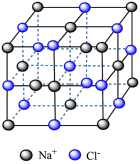
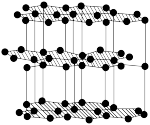
解题方法
1 . 半导体在集成电路、消费电子、通信系统、光伏发电、照明、大功率电源转换等领域都有应用。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是_______ ,原因是_______ 。硅有晶体硅和无定形硅,可以用_______ (填方法名称)来区分晶体硅和无定形硅。
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,立方砷化硼中,_______ (填“含有”或“不含有”)配位键。
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为_______  ;晶胞密度为
;晶胞密度为_______  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用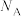 表示)。
表示)。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态
 原子的简化电子排布式为
原子的简化电子排布式为
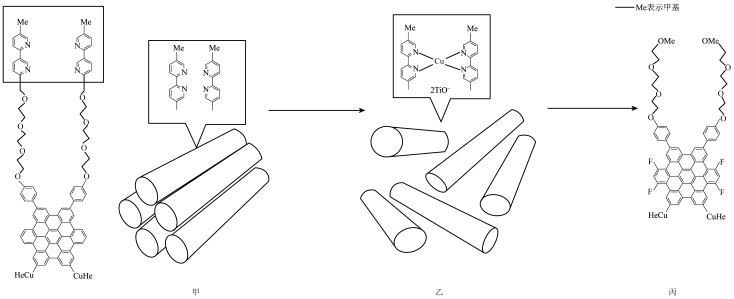
| A.分子识别和自组装是超分子的重要特征 |
B.甲分子中的氮原子的杂化方式均为 |
C.乙分子图示结构部分中,1个 形成了2个配位键 形成了2个配位键 |
| D.丙分子中存在氢键 |
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知
 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为 ;晶胞密度为
;晶胞密度为 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用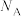 表示)。
表示)。
您最近一年使用:0次
名校
2 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):______ 。
Ⅲ.LiBH4是储氢材料,已知其由Li+和 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的位置______ 。
(5)由元素周期律能得到______。(填序号)
(6)LiBH4中不存在的作用力有______(填序号)。
(7)氢化锂(LiH)是离子化合物。写出其电子式______ ,LiH中负离子半径大于正离子半径,其原因是______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为______ 个。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
| A.C60、Si60、N60分子内部的作用力是共价键 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
Ⅲ.LiBH4是储氢材料,已知其由Li+和
 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。(4)锂位于元素周期表的位置
(5)由元素周期律能得到______。(填序号)
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.沸点:H2O大于HF | D.酸性:HCl大于H2SO3 |
(6)LiBH4中不存在的作用力有______(填序号)。
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(7)氢化锂(LiH)是离子化合物。写出其电子式
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
您最近一年使用:0次
名校
解题方法
3 . 普鲁士蓝可用作钠离子电池的正极材料。放电时 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: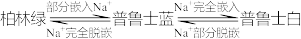 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
| A.从结构上分析,基态Fe3+比基态Fe2+相对更稳定 |
B.普鲁士蓝晶胞中 填充率等于50% 填充率等于50% |
| C.图2中σ键和π键的数目之比为3:2 |
| D.普鲁士白的化学式为NaFe2(CN)6 |
您最近一年使用:0次
2023-09-08更新
|
307次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题
名校
解题方法
4 . 下列说法错误的是
| A.晶体的自范性是晶体中粒子在微观空间呈现周期性的有序排列的宏观表象 |
| B.X射线衍射实验是区分晶体和非晶体最可靠的方法 |
| C.等离子体是一种特殊的液体,由带电的阳离子、电子及电中性粒子的组成 |
| D.液晶既有液体的流动性,又具有类似晶体的各向异性 |
您最近一年使用:0次
2023-09-08更新
|
532次组卷
|
5卷引用:辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题
辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题四川省南充高级中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题1-5(已下线)第三章晶体结构与性质(B卷)
名校
解题方法
5 . 下列关于各晶体模型示意图的分析正确的是
| 名称 |  的晶胞 的晶胞 |  的晶胞 的晶胞 | 晶体碘的晶胞 | 石墨晶体的结构 |
| 模型 示意图 |
|
|
|
|
| 分析 | 1个 晶胞内含有6个 晶胞内含有6个 和6个 和6个 | B.Si原子的配位数为2 | C. 在晶胞中的排列有2种取向 在晶胞中的排列有2种取向 | D.石墨层与层间的主要作用力是共价键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-15更新
|
422次组卷
|
4卷引用:辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题
辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题广西大学附属中学2023-2024学年高二下学期4月月考化学试题广西桂林市2022-2023学年高二下学期期末考试化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
解题方法
6 . 氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

(1)教材中介绍的金刚石的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为_______ 形,立方相氮化硼晶体中,一个B与最近N之间有4个键,而B原子最外层中只有3个电子,推测其中可能有一个键为_______ 键。
(4) (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有_______ mol配位键。
(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有_______ 个N原子、_______ 个B原子。晶胞参数为a pm,则晶体的密度为_______  (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: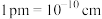 )。
)。

(1)教材中介绍的金刚石的碳原子呈
 ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈 ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中均不含有离子键 |
| D.两种晶体均为分子晶体 |
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为
(4)
 (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有
 (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: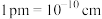 )。
)。
您最近一年使用:0次
解题方法
7 . 铜单质及其化合物在很多领域有重要的用途。
(1)铜单质属于_______ 晶体,铜晶胞如图I所示,一个铜晶胞含有_______ 个铜原子;铜和氧形成的一种离子化合物的晶体结构如图Ⅱ,则化合物中铜元素的化合价为_______ 。

(2)配合物 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是_______ (填化学式),配体是_______ (填化学式),配位数为_______ , 中的N
中的N_______ (填“给出”或“接受”)孤电子对。
(3) 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈_______ 形,n=_______ 。
(4) 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):

①乙二胺和三甲胺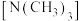 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:_______ 。
②配合物 中不存在的作用力类型有
中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
(1)铜单质属于

(2)配合物
 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是 中的N
中的N(3)
 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈(4)
 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):
①乙二胺和三甲胺
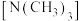 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:②配合物
 中不存在的作用力类型有
中不存在的作用力类型有A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
您最近一年使用:0次
解题方法
8 . 硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于_______ 晶体, 属于
属于_______ 晶体,石墨属于_______ 晶体,它们都是碳元素的_______ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以 为代表,结构如下图。
为代表,结构如下图。
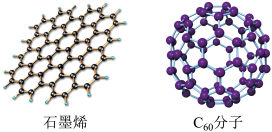
从石墨中剥离得到石墨烯需克服的作用是_______ ;在石墨烯中,每个六元环占有_______ 个C原子。1mol  分子中σ键数为
分子中σ键数为_______ (用 表示)。
表示)。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):_______ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:_______ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 )的△H=
)的△H=_______ kJ/mol。
(1)金刚石属于
 属于
属于(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以
 为代表,结构如下图。
为代表,结构如下图。
从石墨中剥离得到石墨烯需克服的作用是
 分子中σ键数为
分子中σ键数为 表示)。
表示)。(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能kJ/mol | 360 | 436 | 431 | 176 |
 )的△H=
)的△H=
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是___________ 。气态三氧化硫以单分子形式存在,其分子的空间结构为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。

(2)分子中的大π键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为___________ 。SO2分子中键角∠OSO___________  中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。
(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为___________ 。下图中表示的碳原子能量最高的是___________ (填字母)。
A. B.
B.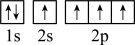
C. D.
D.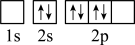
(4)三甲胺 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是___________ 。C60的熔点比金刚石、石墨熔点低的原因是___________ 。
(5)在冰晶体中除氢键外,还存在范德华力 。已知冰的升华热是
。已知冰的升华热是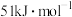 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少___________  。
。
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是

(2)分子中的大π键可用符号
 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为 中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为A.
 B.
B.
C.
 D.
D.
(4)三甲胺
 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(5)在冰晶体中除氢键外,还存在范德华力
 。已知冰的升华热是
。已知冰的升华热是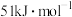 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少 。
。
您最近一年使用:0次
解题方法
10 . 黄铜矿(主要成分为 )是生产铜、铁和硫酸的原料。请回答下列问题:
)是生产铜、铁和硫酸的原料。请回答下列问题:
(1)基态Cu原子的价层电子排布式为_______ 。
(2)从原子结构角度分析,第一电离能 与
与 的关系是
的关系是
_______ (填“<”或“=”) 。
。
(3)血红素是吡咯(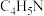 )的重要衍生物,血红素(含
)的重要衍生物,血红素(含 )可用于治疗缺铁性贫血。吡咯的结构简式如图:
)可用于治疗缺铁性贫血。吡咯的结构简式如图:

①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______ 。
②1 mol吡咯分子中所含的 键总数为
键总数为_______ 个。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为_______ (填化学式)。
(4)黄铜矿冶炼铜时产生的 可经过
可经过 途径形成酸雨。
途径形成酸雨。 的空间结构为
的空间结构为_______ 。 的酸性强于
的酸性强于 的酸性的原因是
的酸性的原因是_______ 。
 )是生产铜、铁和硫酸的原料。请回答下列问题:
)是生产铜、铁和硫酸的原料。请回答下列问题:(1)基态Cu原子的价层电子排布式为
(2)从原子结构角度分析,第一电离能
 与
与 的关系是
的关系是
 。
。(3)血红素是吡咯(
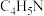 )的重要衍生物,血红素(含
)的重要衍生物,血红素(含 )可用于治疗缺铁性贫血。吡咯的结构简式如图:
)可用于治疗缺铁性贫血。吡咯的结构简式如图:
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1 mol吡咯分子中所含的
 键总数为
键总数为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为
(4)黄铜矿冶炼铜时产生的
 可经过
可经过 途径形成酸雨。
途径形成酸雨。 的空间结构为
的空间结构为 的酸性强于
的酸性强于 的酸性的原因是
的酸性的原因是
您最近一年使用:0次