名校
解题方法
1 . X、Y、Z、V、M、W为五种短周期元素,其中X是短周期元素中金属性最强的元素;Y与X同周期,是同周期简单离子中半径最小的;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为1s22s22p63s2;M处于第三周期,其单质为淡黄色固体;W的一种同位素原子无中子。回答下列问题:
(1)M与W形成的分子是___ (填“极性分子”或“非极性分子”);与该分子互为等电子体的一种阴离子为(写化学式)___ 。
(2)元素X、Y、V第一电离能由小到大的顺序是___ (用元素符号表示)。
(3)ZW3气体易溶于水的原因是___ 。(写两点)
(4)M8是___ 晶体,该晶体中微粒间的作用力为___ ;
(5)X的最高价氧化物的水化物和Y的最高价氧化物相互反应的离子方程式___ 。
(1)M与W形成的分子是
(2)元素X、Y、V第一电离能由小到大的顺序是
(3)ZW3气体易溶于水的原因是
(4)M8是
(5)X的最高价氧化物的水化物和Y的最高价氧化物相互反应的离子方程式
您最近一年使用:0次
2020-11-24更新
|
149次组卷
|
2卷引用:辽宁省盘锦市第二高级中学2020-2021学年高二下学期第一阶段考试化学试题
解题方法
2 . D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物形成的分子的键角是__________ 度;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是___________ ,写出该元素的任意2种含氧酸的化学式:___________________________________ ;
(3)D的氢化物与X的氢化物沸点比较,沸点高的是________ (填化学式),原因是_________________________
(4)D 分别与Y、Z形成的化合物中D采用的杂化方式为_______ 、 _________ .
(5)E的氢化物与Z的氢化物反应后生成的物质存在的化学键有_______
A: 离子键 B:极性共价键 C:非极性共价键 D:配位键
(1)Y的最高价氧化物形成的分子的键角是
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
(3)D的氢化物与X的氢化物沸点比较,沸点高的是
(4)D 分别与Y、Z形成的化合物中D采用的杂化方式为
(5)E的氢化物与Z的氢化物反应后生成的物质存在的化学键有
A: 离子键 B:极性共价键 C:非极性共价键 D:配位键
您最近一年使用:0次
2020-11-01更新
|
101次组卷
|
2卷引用:辽宁省盘锦市第二高级中学2020-2021学年高二下学期第一阶段考试化学试题
名校
解题方法
3 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)Co 属于元素周期表中______ 区元素,其基态原子的价电子排布式为______ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为______ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为______ (用元素符号表示)。
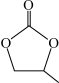
(4)ClO4 -的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______ ,1mol碳酸丙烯酯中 键的数目为
键的数目为______ 。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______ ,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
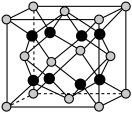
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏加 德罗常数的值为NA,则Na与O之间的最短距离为______ nm(用含ρ、NA的代数式表示)。
(1)Co 属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为
(4)ClO4 -的几何构型为
 键的数目为
键的数目为
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
名校
解题方法
4 . 硫元素最常见和最稳定的一种同素异形体是黄色的正交a-型,1912年 E.Beckmann由硫在碘中的冰点降低法测得它含有Sg分子,1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了ɛ一种菱形的硫,后来证明含有S6分子。下列说法正确的是
| A.S6和S8互为同位素 |
| B.S6和S8分子分别与铁粉反应,所得产物不同 |
| C.S6和S8分子分别与过量的氧气反应可以得到SO3 |
| D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同 |
您最近一年使用:0次
5 . 黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1) 基态锌原子的核外价电子排布式为_______________ ,属于周期表__________ 区元素。电子占据最高能层的符号是_______________ 占据该能层电子的电子云轮廓图形状为______________
(2)第一电离能I1(Zn)________ I1(Cu)(填“大于”或“小于”)
(3)向蓝色 硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
①下列微粒中与SO42-互为等电子体的是__________ (填序号)。
A.H2SO4 B.CO32- C.PO43- D.CCl4
②H2O分子中心原子的杂化类型为______ ;NH3分子的空间构型为________ 。
分子中的键角:H2O_______ NH3(填“大于”或“小于”)。
③通过上述实验现象可知:与Cu2+与的配位能力H2O_________ NH3 (填“大于”或“小于”)。
④极具应用前景的氨硼烷(BH3·NH3)与乙烷互为等电子体。写出BH3·NH3的结构式(结构中若含配位键用“ ”表示)
”表示)_______________________
(4)金属Cu晶体中的原子堆积方式如图所示,这种堆积方式称为_____________ 。

(5)若Cu晶体的密度为ρg/cm3, 表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离________ nm(不必化简)
(1) 基态锌原子的核外价电子排布式为
(2)第一电离能I1(Zn)
(3)向蓝色
 硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。①下列微粒中与SO42-互为等电子体的是
A.H2SO4 B.CO32- C.PO43- D.CCl4
②H2O分子中心原子的杂化类型为
分子中的键角:H2O
③通过上述实验现象可知:与Cu2+与的配位能力H2O
④极具应用前景的氨硼烷(BH3·NH3)与乙烷互为等电子体。写出BH3·NH3的结构式(结构中若含配位键用“
 ”表示)
”表示)(4)金属Cu晶体中的原子堆积方式如图所示,这种堆积方式称为

(5)若Cu晶体的密度为ρg/cm3,
 表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
您最近一年使用:0次
9-10高一下·河北·期中
名校
6 . 元素的性质呈周期性变化的根本原因是( )
| A.元素相对原子质量的递增,量变引起质变 |
| B.元素的原子半径周期性变化 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
您最近一年使用:0次
2019-10-30更新
|
330次组卷
|
21卷引用:2011-2012学年辽宁省盘锦市二中高一下学期期中考试化学试卷
(已下线)2011-2012学年辽宁省盘锦市二中高一下学期期中考试化学试卷(已下线)2009-2010学年乐亭一中高一第二学期期中化学试题(已下线)09~10学年延安实验中学高一下学期期中考试化学卷(已下线)09~10年长沙同升湖实验学校高一下学期期末考试化学卷(已下线)2010-2011学年江苏省南京实验国际学校高一下学期期中考试化学试卷(已下线)2011-2012学年浙江省东阳市南马高中高一下学期期中考试化学试卷(已下线)2011-2012年浙江宁波万里国际中学高一第二学期期中考试化学试卷(已下线)2012-2013学年浙江宁波万里国际学校高一下学期期中考试化学试卷(已下线)2013-2014学年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2013-2014学年辽宁省大连普通高中高二上学期期末考试文科化学试卷2015-2016学年辽宁省大连第二十高级中学高一下第一次月考化学试卷2015-2016学年江西省崇义中学高一下学期第一次月考化学试卷2015-2016学年湖北省孝感市六校联盟高一下学期期中考试化学试卷2015-2016学年河北省枣强中学高一下期中化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷【全国百强校】贵州省凯里市第一中学2018-2019学年高一(文)下学期期中考试化学试题湖南省张家界市2018-2019学年高一下学期期末考试化学试题上海市嘉定二中2018-2019学年高二(合格考)上学期期中试卷化学试题山西省忻州市第一中学人教版高一化学必修二同步检测:1.2.1元素周期律第1课时原子核外的电子排布元素周期律山东省枣庄市第三中学2019-2020学年高一3月网上测试化学试题辽宁省沈阳市第一七O中学2021-2022学年高二上学期教学质量检测化学试题
名校
7 . 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为_____ ;
②此配离子中碳原子的杂化轨道类型为_____ ;
③此配离子中含有的化学键为_____ 。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____ 。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____ 。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____ (请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____ ,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____ nm(列计算式)。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

①此配合物中,铁离子价电子排布图为
②此配离子中碳原子的杂化轨道类型为
③此配离子中含有的化学键为
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为
您最近一年使用:0次
2018-01-25更新
|
714次组卷
|
5卷引用:辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题



