名校
解题方法
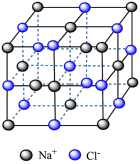
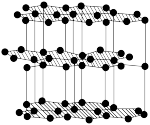
1 . 下列关于各晶体模型示意图的分析正确的是
| 名称 |  的晶胞 的晶胞 |  的晶胞 的晶胞 | 晶体碘的晶胞 | 石墨晶体的结构 |
| 模型 示意图 |
|
|
|
|
| 分析 | 1个 晶胞内含有6个 晶胞内含有6个 和6个 和6个 | B.Si原子的配位数为2 | C. 在晶胞中的排列有2种取向 在晶胞中的排列有2种取向 | D.石墨层与层间的主要作用力是共价键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-15更新
|
420次组卷
|
3卷引用:辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题
解题方法
2 . 氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

(1)教材中介绍的金刚石的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为_______ 形,立方相氮化硼晶体中,一个B与最近N之间有4个键,而B原子最外层中只有3个电子,推测其中可能有一个键为_______ 键。
(4) (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有_______ mol配位键。
(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有_______ 个N原子、_______ 个B原子。晶胞参数为a pm,则晶体的密度为_______  (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: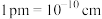 )。
)。

(1)教材中介绍的金刚石的碳原子呈
 ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈 ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中均不含有离子键 |
| D.两种晶体均为分子晶体 |
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为
(4)
 (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有
 (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: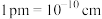 )。
)。
您最近一年使用:0次
解题方法
3 . 铜单质及其化合物在很多领域有重要的用途。
(1)铜单质属于_______ 晶体,铜晶胞如图I所示,一个铜晶胞含有_______ 个铜原子;铜和氧形成的一种离子化合物的晶体结构如图Ⅱ,则化合物中铜元素的化合价为_______ 。

(2)配合物 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是_______ (填化学式),配体是_______ (填化学式),配位数为_______ , 中的N
中的N_______ (填“给出”或“接受”)孤电子对。
(3) 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈_______ 形,n=_______ 。
(4) 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):

①乙二胺和三甲胺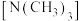 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:_______ 。
②配合物 中不存在的作用力类型有
中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
(1)铜单质属于

(2)配合物
 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是 中的N
中的N(3)
 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈(4)
 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):
①乙二胺和三甲胺
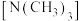 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:②配合物
 中不存在的作用力类型有
中不存在的作用力类型有A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
您最近一年使用:0次
解题方法
4 . 硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于_______ 晶体, 属于
属于_______ 晶体,石墨属于_______ 晶体,它们都是碳元素的_______ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以 为代表,结构如下图。
为代表,结构如下图。
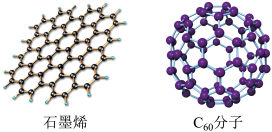
从石墨中剥离得到石墨烯需克服的作用是_______ ;在石墨烯中,每个六元环占有_______ 个C原子。1mol  分子中σ键数为
分子中σ键数为_______ (用 表示)。
表示)。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):_______ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:_______ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 )的△H=
)的△H=_______ kJ/mol。
(1)金刚石属于
 属于
属于(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以
 为代表,结构如下图。
为代表,结构如下图。
从石墨中剥离得到石墨烯需克服的作用是
 分子中σ键数为
分子中σ键数为 表示)。
表示)。(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能kJ/mol | 360 | 436 | 431 | 176 |
 )的△H=
)的△H=
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是___________ 。气态三氧化硫以单分子形式存在,其分子的空间结构为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。

(2)分子中的大π键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为___________ 。SO2分子中键角∠OSO___________  中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。
(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为___________ 。下图中表示的碳原子能量最高的是___________ (填字母)。
A. B.
B.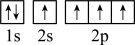
C. D.
D.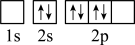
(4)三甲胺 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是___________ 。C60的熔点比金刚石、石墨熔点低的原因是___________ 。
(5)在冰晶体中除氢键外,还存在范德华力 。已知冰的升华热是
。已知冰的升华热是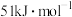 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少___________  。
。
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是

(2)分子中的大π键可用符号
 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为 中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为A.
 B.
B.
C.
 D.
D.
(4)三甲胺
 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(5)在冰晶体中除氢键外,还存在范德华力
 。已知冰的升华热是
。已知冰的升华热是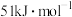 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少 。
。
您最近一年使用:0次
6 . 黑火药的爆炸反应原理为2KNO3+3C+S K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:
(1)基态O原子的核外电子排布式为___________ ;基态18O原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用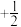 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.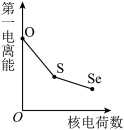 b.
b.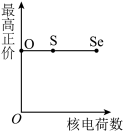 c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为___________ kJ/mol;O=O键的键能为___________ kJ/mol;氧原子的第一电子亲和能为___________ kJ/mol。
 K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:(1)基态O原子的核外电子排布式为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
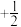 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为
您最近一年使用:0次
2023-03-10更新
|
392次组卷
|
2卷引用:辽宁省沈阳市四校2023届高三上学期1月联合质检卷化学试题
名校
解题方法
7 .  失水后可转为
失水后可转为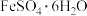 ,
,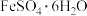 结构如图。下列说法正确的是
结构如图。下列说法正确的是
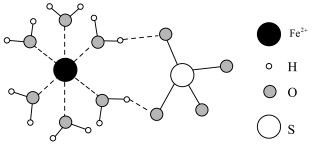
 失水后可转为
失水后可转为 ,
, 结构如图。下列说法正确的是
结构如图。下列说法正确的是
A. 位于周期表 位于周期表 区 区 |
B. 中键角 中键角 小于 小于 中键角 中键角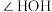 |
C.此结构中 与 与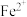 、 、 与 与 离子之间的作用力相同 离子之间的作用力相同 |
| D.基态O原子核外电子有5种空间运动状态 |
您最近一年使用:0次
2023-02-11更新
|
1137次组卷
|
2卷引用:辽宁省东北育才学校等五校2022-2023学年高三上学期期末考试化学试题
名校
解题方法
8 . Ⅰ.X、Y、Q、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态N原子d轨道中成对电子与单电子的数目比为4∶3。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示
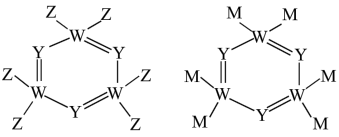
(1)基态W原子的电子排布式为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形,第三周期中第一电离能均大于同周期相邻元素的是_______ (填元素符号)
(2)W、M形成的一种化合物以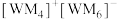 的形式存在,
的形式存在,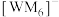 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,下列对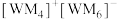 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.
Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
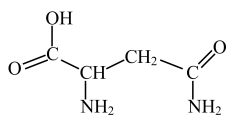
(3)天冬酰胺中碳原子的杂化轨道类型有_______ 种。有_______ 个手性碳原子。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇( ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是_______ 。
(5)已知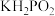 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为_______
(6) 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示:
,其结构如图所示:
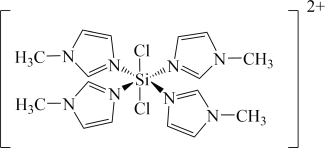
N-甲基咪唑分子中氮原子的杂化轨道类型为_______ 。
(7) 的结构如图:
的结构如图:
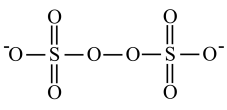
① 中
中
_______ (填“是”或“不是”)在一条直线上。
② 中的
中的 比
比 中的更
中的更_______ (填“难”或“易”)断裂。
(8)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是_______
A. B.
B. C.
C. D.
D. E.
E.
(9)金属镍粉在 气流中轻微加热,生成无色挥发性液体
气流中轻微加热,生成无色挥发性液体 ,呈正四面体构型,易溶于下列物质中的_______(填序号)。
,呈正四面体构型,易溶于下列物质中的_______(填序号)。

(1)基态W原子的电子排布式为
(2)W、M形成的一种化合物以
 的形式存在,
的形式存在, 中心原子的价层电子对数为
中心原子的价层电子对数为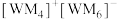 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是a.
 b.
b. c.
c. d.
d.
Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(3)天冬酰胺中碳原子的杂化轨道类型有
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(
 ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是(5)已知
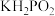 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为(6)
 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到
)反应可以得到 ,其结构如图所示:
,其结构如图所示:
N-甲基咪唑分子中氮原子的杂化轨道类型为
(7)
 的结构如图:
的结构如图:
①
 中
中
②
 中的
中的 比
比 中的更
中的更(8)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.
 B.
B. C.
C. D.
D. E.
E.
(9)金属镍粉在
 气流中轻微加热,生成无色挥发性液体
气流中轻微加热,生成无色挥发性液体 ,呈正四面体构型,易溶于下列物质中的_______(填序号)。
,呈正四面体构型,易溶于下列物质中的_______(填序号)。| A.水 | B. | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
解题方法
9 . 2022年北京冬季奥运会场馆使用了大量不锈钢材质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬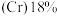 、含镍
、含镍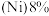 。回答下列问题:
。回答下列问题:
(1)不锈钢所属的晶体类型为_______ 。
(2)铁系元素能与 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点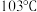 ,则该晶体的晶体类型为
,则该晶体的晶体类型为_______ 晶体, 中含有的化学键类型包括
中含有的化学键类型包括_______ (填字母)。
A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与 可形成低价态氧化物
可形成低价态氧化物 。
。
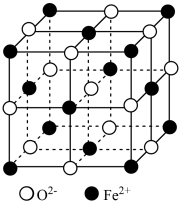
① 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为_______ ;与 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为_______ 。
②若 与
与 之间最近距离为
之间最近距离为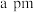 ,则该晶体的密度计算式为
,则该晶体的密度计算式为_______  。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
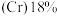 、含镍
、含镍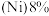 。回答下列问题:
。回答下列问题:(1)不锈钢所属的晶体类型为
(2)铁系元素能与
 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点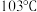 ,则该晶体的晶体类型为
,则该晶体的晶体类型为 中含有的化学键类型包括
中含有的化学键类型包括A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与
 可形成低价态氧化物
可形成低价态氧化物 。
。
①
 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为②若
 与
与 之间最近距离为
之间最近距离为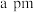 ,则该晶体的密度计算式为
,则该晶体的密度计算式为 。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
10 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染,其结构简式如图所示。下列说法正确的是
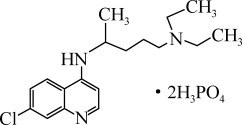
| A.第一电离能:O>N>C | B.该有机物中碳原子采取sp、 杂化 杂化 |
| C.基态氢原子电子云轮廓图为哑铃形 | D. 的空间结构与VSEPR模型相同 的空间结构与VSEPR模型相同 |
您最近一年使用:0次
2022-03-22更新
|
797次组卷
|
5卷引用:辽宁省沈阳市东北育才学校科学高中2021-2022学年高二下学期线上4月测试化学试题
辽宁省沈阳市东北育才学校科学高中2021-2022学年高二下学期线上4月测试化学试题湖南省名校联考联合体2021-2022学年高二下学期3月联考化学试题浙江省杭州第二中学2023届高三下学期3月月考化学试题(已下线)化学-2023年高考押题预测卷03(浙江卷)(含考试版、全解全析、参考答案、答题卡)吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题