名校
1 . 下列说法错误的是
| A.晶体的自范性是晶体中粒子在微观空间呈现周期性的有序排列的宏观表象 |
| B.等离子体是一种特殊的液体,由带电的阳离子、电子及电中性粒子的组成 |
| C.X射线衍射实验可测定晶胞中各粒子的位置,判断键长、键角和分子结构 |
| D.液晶既有液体的流动性,又具有类似晶体的各向异性 |
您最近半年使用:0次
名校
2 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是___________(填字母)。
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的___________ 区。
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有___________ (填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为___________ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有___________ ,如表是2种二烃基锌的沸点数据,则烃基R1是___________ ,推断的依据是___________ 。
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为___________ 。
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是___________(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
①Zr是Ti的同族相邻元素,位于周期表的
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(℃) | 46 | 118 |

您最近半年使用:0次
3 . 将铁粉在NH3和H2的混合气氛中加热,可得含Fe和N的磁性材料,其晶体的晶胞如下图,晶胞边长均为apm。下列说法不正确 的是
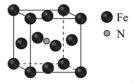
| A.距离N最近的Fe有6个 |
B.Fe之间的最近距离为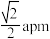 |
C.该晶体的密度为 g·cm-3 g·cm-3 |
| D.若将N置于晶胞顶点,则Fe位于体心和棱心 |
您最近半年使用:0次
解题方法
4 . 回答下列问题。
(1)从结构角度分析, 较
较 稳定的原因是
稳定的原因是__________ 。
(2)类卤素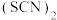 分子中
分子中 键与
键与 键的数目比
键的数目比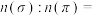
__________ 。
(3) 的熔点高于1000℃,
的熔点高于1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是__________ 。
(4)有机物尿素 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为__________ 。
(5)吡咯(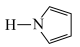 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为__________ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。__________ .
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距
,则X中相邻K之间的最短距__________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)从结构角度分析,
 较
较 稳定的原因是
稳定的原因是(2)类卤素
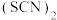 分子中
分子中 键与
键与 键的数目比
键的数目比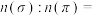
(3)
 的熔点高于1000℃,
的熔点高于1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是(4)有机物尿素
 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为(5)吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距
,则X中相邻K之间的最短距 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
2024·北京·模拟预测
5 . 金属镍及其化合物在合成材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态Ni原子的价电子排布图为___________ 。
(2)NiO、FeO晶体类型及晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为___________ ;又知Ni2+、Fe2+的离子半径分别为69pm、78pm,则NiO熔点___________ FeO(填“>”“<”或“=”)。
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中C原子的杂化类型为___________ ;元素H、C、N、O、Ni电负性由大到小的顺序为___________ 。___________ ;晶体密度为___________ g·cm-3(列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
(1)基态Ni原子的价电子排布图为
(2)NiO、FeO晶体类型及晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中C原子的杂化类型为
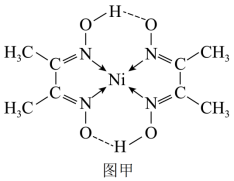

您最近半年使用:0次
2024·北京·模拟预测
6 . 下列有关物质结构与性质的说法正确的是
| A.雪花是天空中的水汽经凝华而来的一种晶体,其六角形形状与氢键的方向性有关 |
| B.某基态原子的价层电子排布为4d25s2,该原子N层上有3个空轨道 |
| C.C=C键的键能比C—C键的大,所以碳碳双键的化学性质比碳碳单键稳定 |
| D.碘易溶于浓碘化钾溶液,甲烷难溶于水都可用“相似相溶”原理解释 |
您最近半年使用:0次
7 . A、B、C、D、E是五种原子序数依次递增的短周期元素。已知:A的一种同位素可以用于测定文物的年代;基态C原子含3对成对电子;D在同周期金属元素中第一电离能最大;基态E原子的3p轨道中含有自旋方向不同且数目之比为3:1的电子。下列说法正确的是
| A.简单离子的离子半径:B<C<D<E |
| B.简单氢化物的沸点:A<B<C<E |
| C.D的单质可以在A和C形成的某种化合物中燃烧 |
| D.Xe(氙)是目前最易形成化合物的稀有气体,XeC3为非极性分子 |
您最近半年使用:0次
名校
解题方法
8 . 下列关于晶体的说法,不正确的是
①晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无自范性;
②含有金属阳离子的晶体一定是离子晶体;
③共价键可决定分子晶体的熔、沸点;
④用质谱法区分晶体与非晶体;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑥ 受热分解生成
受热分解生成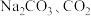 和H2O,既破坏了离子键,也破坏了共价键;
和H2O,既破坏了离子键,也破坏了共价键;
①晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无自范性;
②含有金属阳离子的晶体一定是离子晶体;
③共价键可决定分子晶体的熔、沸点;
④用质谱法区分晶体与非晶体;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑥
 受热分解生成
受热分解生成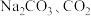 和H2O,既破坏了离子键,也破坏了共价键;
和H2O,既破坏了离子键,也破坏了共价键;| A.①②③ | B.②③⑥ | C.④⑤⑥ | D.②③④ |
您最近半年使用:0次
9 . Ⅰ.氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物O2F2、OF2的结构已经确定。
①依据数据推测O—O键的稳定性:O2F2___________ H2O2(填“>”或“<”)。
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:___________ 。
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:___________ 。
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取 的流程如下:
的流程如下: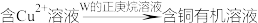
(4)有机化合物W的结构简式为:___________ 种,N、O杂化轨道类型分别为___________ 、___________ 。
(5)W可与 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: 的价电子排布式为
的价电子排布式为___________ 。
②氢键对Q在水中溶解性的影响是___________ (填“增大”或“减小”)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物O2F2、OF2的结构已经确定。
| O2F2 | H2O2 | |
| O—O键长/pm | 121 | 148 |
②OF2中F-O-F的键角小于H2O中H-O-H的键角,解释原因:
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体中HF分子排列成锯齿形。画出含2个HF的重复单元结构:
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程式:
Ⅱ.金属冶炼过程中一种用有机化合物从水溶液中提取
 的流程如下:
的流程如下: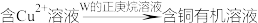
(4)有机化合物W的结构简式为:
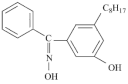
(5)W可与
 形成化合物Q,其结构如下所示:
形成化合物Q,其结构如下所示: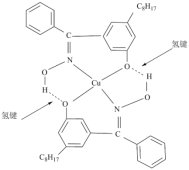
 的价电子排布式为
的价电子排布式为②氢键对Q在水中溶解性的影响是
您最近半年使用:0次
名校
解题方法
10 . 硫、铬、铁、铜等元素分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。根据要求回答下列问题:
(1)硫元素在周期表中的位置为___________ 。
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如图所示。___________ ;
②基态Fe2+的核外价层电子排布式为___________ 。
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行___________ 实验。
(5)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为___________ 。 分子中键角
分子中键角
___________  中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(1)硫元素在周期表中的位置为
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
| A.[Ar]3d54s1 | B.[Ar]3d44s14p1 | C.[Ar]3d5 | D.[Ar]3d54p1 |
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如图所示。
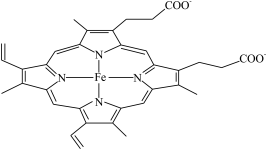
②基态Fe2+的核外价层电子排布式为
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行
(5)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近半年使用:0次



