真题
解题方法
1 . 氢元素及其化合物在自然界广泛存在且具有重要应用。 、
、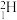 、
、 是氢元素的3种核素,基态H原子
是氢元素的3种核素,基态H原子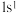 的核外电子排布,使得H既可以形成
的核外电子排布,使得H既可以形成 又可以形成
又可以形成 ,还能形成
,还能形成 、
、 、
、 、
、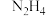 、
、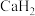 等重要化合物;水煤气法、电解水、光催化分解水都能获得
等重要化合物;水煤气法、电解水、光催化分解水都能获得 ,如水煤气法制氢反应中,
,如水煤气法制氢反应中, 与足量
与足量 反应生成
反应生成 和
和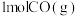 吸收131.3kJ的热量。
吸收131.3kJ的热量。 在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如 在催化剂作用下与
在催化剂作用下与 反应可得到
反应可得到 。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列物质结构与性质或物质性质与用途具有对应关系的是
。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列物质结构与性质或物质性质与用途具有对应关系的是
 、
、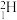 、
、 是氢元素的3种核素,基态H原子
是氢元素的3种核素,基态H原子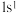 的核外电子排布,使得H既可以形成
的核外电子排布,使得H既可以形成 又可以形成
又可以形成 ,还能形成
,还能形成 、
、 、
、 、
、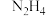 、
、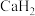 等重要化合物;水煤气法、电解水、光催化分解水都能获得
等重要化合物;水煤气法、电解水、光催化分解水都能获得 ,如水煤气法制氢反应中,
,如水煤气法制氢反应中, 与足量
与足量 反应生成
反应生成 和
和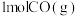 吸收131.3kJ的热量。
吸收131.3kJ的热量。 在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如 在催化剂作用下与
在催化剂作用下与 反应可得到
反应可得到 。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列物质结构与性质或物质性质与用途具有对应关系的是
。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列物质结构与性质或物质性质与用途具有对应关系的是A. 具有还原性,可作为氢氧燃料电池的燃料 具有还原性,可作为氢氧燃料电池的燃料 |
| B.氨极易溶于水,液氨可用作制冷剂 |
C. 分子之间形成氢键, 分子之间形成氢键, 的热稳定性比 的热稳定性比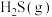 的高 的高 |
D.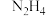 中的N原子与 中的N原子与 形成配位键, 形成配位键,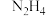 具有还原性 具有还原性 |
您最近半年使用:0次
2 . 下列有关元素单质或化合物的叙述正确的是
A. 分子呈正四面体,键角为 分子呈正四面体,键角为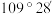 |
| B.NaCl焰色试验为黄色,与Cl电子跃迁有关 |
| C.Cu基态原子核外电子排布符合构造原理 |
D. 是由极性键构成的极性分子 是由极性键构成的极性分子 |
您最近半年使用:0次
2023-08-03更新
|
4596次组卷
|
12卷引用:2023年高考海南卷化学真题
2023年高考海南卷化学真题(已下线)单项选择题(已下线)第21讲分子结构与性质重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题湖北省武汉市武钢三中2023-2024学年高二下学期3月月考化学试题福建省永春第一中学2023-2024学年高二下学期3月月考化学试题山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷天津市南开中学2023-2024学年高二下学期期中考试化学试卷广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题海南省文昌中学2023-2024学年高二下学期期中段考化学试题
真题
3 . 氮的化合物种类繁多,应用广泛。
请回答:
(1)基态N原子的价层电子排布式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确 的是___________ 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式: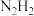
D.氮烷中N原子的杂化方式都是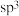
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为______ 。
③给出 的能力:
的能力:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是___________ 。
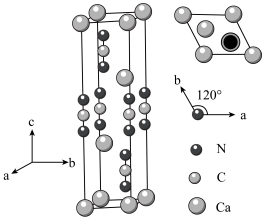
(3)某含氮化合物晶胞如图,其化学式为___________ ,每个阴离子团的配位数(紧邻的阳离子数)为___________ 。

请回答:
(1)基态N原子的价层电子排布式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法
A.能量最低的激发态N原子的电子排布式:

B.化学键中离子键成分的百分数:

C.最简单的氮烯分子式:
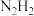
D.氮烷中N原子的杂化方式都是
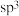
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为
③给出
 的能力:
的能力:
 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3)某含氮化合物晶胞如图,其化学式为
您最近半年使用:0次
4 . 工业中可利用生产钛白的副产物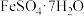 和硫铁矿
和硫铁矿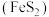 联合制备铁精粉
联合制备铁精粉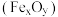 和硫酸,实现能源及资源的有效利用。
和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图1。
结构示意图如图1。

① 的价层电子排布式为
的价层电子排布式为___________ 。
② 中O和
中O和 中S均为
中S均为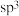 杂化,比较
杂化,比较 中
中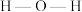 键角和
键角和 中
中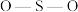 键角的大小并解释原因
键角的大小并解释原因___________ 。
③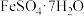 中
中 与
与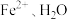 与
与 的作用力类型分别是
的作用力类型分别是___________ 。
(2) 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图2。
,结构如图2。
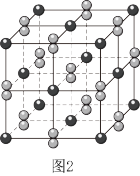
①距离 最近的阴离子有
最近的阴离子有___________ 个。
② 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 。
。
该晶体的密度为___________  。
。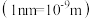
(3)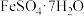 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如图3。利用
在氧气中燃烧的能量示意图如图3。利用 作为
作为 分解的燃料,从能源及资源利用的角度说明该工艺的优点
分解的燃料,从能源及资源利用的角度说明该工艺的优点___________ 。

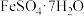 和硫铁矿
和硫铁矿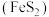 联合制备铁精粉
联合制备铁精粉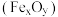 和硫酸,实现能源及资源的有效利用。
和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图1。
结构示意图如图1。
①
 的价层电子排布式为
的价层电子排布式为②
 中O和
中O和 中S均为
中S均为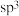 杂化,比较
杂化,比较 中
中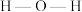 键角和
键角和 中
中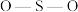 键角的大小并解释原因
键角的大小并解释原因③
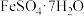 中
中 与
与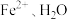 与
与 的作用力类型分别是
的作用力类型分别是(2)
 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图2。
,结构如图2。
①距离
 最近的阴离子有
最近的阴离子有②
 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 。
。该晶体的密度为
 。
。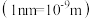
(3)
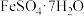 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如图3。利用
在氧气中燃烧的能量示意图如图3。利用 作为
作为 分解的燃料,从能源及资源利用的角度说明该工艺的优点
分解的燃料,从能源及资源利用的角度说明该工艺的优点
您最近半年使用:0次
2022-09-08更新
|
9204次组卷
|
10卷引用:2022年北京市高考真题化学试题
2022年北京市高考真题化学试题(已下线)北京市第四中学2022-2023学年高三上学期阶段测试2化学试题北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题广东省江门市第一中学2022-2023学年高二下学期3月月考化学试题(已下线)2022年北京高考真题化学试题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京市第一七一中学2023-2024学年高三上学期10月考化学试题 北京市第一○一中学2023-2024学年高三上学期12月统练六化学试题
5 . 硫铁化合物( 、
、 等)应用广泛。
等)应用广泛。
(1)纳米 可去除水中微量六价铬
可去除水中微量六价铬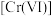 。在
。在 的水溶液中,纳米
的水溶液中,纳米 颗粒表面带正电荷,
颗粒表面带正电荷,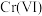 主要以
主要以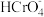 、
、 、
、 等形式存在,纳米
等形式存在,纳米 去除水中
去除水中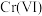 主要经过“吸附→反应→沉淀”的过程。
主要经过“吸附→反应→沉淀”的过程。
已知: ,
,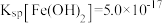 ;
; 电离常数分别为
电离常数分别为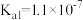 、
、 。
。
①在弱碱性溶液中, 与
与 反应生成
反应生成 、
、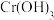 和单质S,其离子方程式为
和单质S,其离子方程式为_______ 。
②在弱酸性溶液中,反应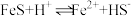 的平衡常数K的数值为
的平衡常数K的数值为_______ 。
③在 溶液中,pH越大,
溶液中,pH越大, 去除水中
去除水中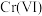 的速率越慢,原因是
的速率越慢,原因是_______ 。
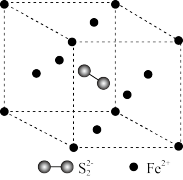
(2) 具有良好半导体性能。
具有良好半导体性能。 的一种晶体与
的一种晶体与 晶体的结构相似,该
晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中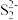 的数目为
的数目为_______ ,在 晶体中,每个S原子与三个
晶体中,每个S原子与三个 紧邻,且
紧邻,且 间距相等,如图给出了
间距相等,如图给出了 晶胞中的
晶胞中的 和位于晶胞体心的
和位于晶胞体心的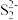 (
(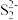 中的
中的 键位于晶胞体对角线上,晶胞中的其他
键位于晶胞体对角线上,晶胞中的其他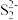 已省略)。如图中用“-”将其中一个S原子与紧邻的
已省略)。如图中用“-”将其中一个S原子与紧邻的 连接起来
连接起来_______ 。
(3) 、
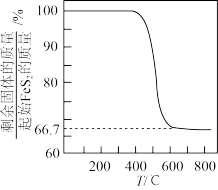
、 在空气中易被氧化,将
在空气中易被氧化,将 在空气中氧化,测得氧化过程中剩余固体的质量与起始
在空气中氧化,测得氧化过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。
的质量的比值随温度变化的曲线如图所示。 时,
时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为_______ (填化学式,写出计算过程)。
 、
、 等)应用广泛。
等)应用广泛。(1)纳米
 可去除水中微量六价铬
可去除水中微量六价铬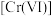 。在
。在 的水溶液中,纳米
的水溶液中,纳米 颗粒表面带正电荷,
颗粒表面带正电荷,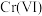 主要以
主要以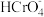 、
、 、
、 等形式存在,纳米
等形式存在,纳米 去除水中
去除水中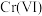 主要经过“吸附→反应→沉淀”的过程。
主要经过“吸附→反应→沉淀”的过程。已知:
 ,
,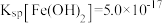 ;
; 电离常数分别为
电离常数分别为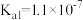 、
、 。
。①在弱碱性溶液中,
 与
与 反应生成
反应生成 、
、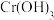 和单质S,其离子方程式为
和单质S,其离子方程式为②在弱酸性溶液中,反应
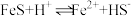 的平衡常数K的数值为
的平衡常数K的数值为③在
 溶液中,pH越大,
溶液中,pH越大, 去除水中
去除水中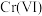 的速率越慢,原因是
的速率越慢,原因是(2)
 具有良好半导体性能。
具有良好半导体性能。 的一种晶体与
的一种晶体与 晶体的结构相似,该
晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中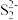 的数目为
的数目为 晶体中,每个S原子与三个
晶体中,每个S原子与三个 紧邻,且
紧邻,且 间距相等,如图给出了
间距相等,如图给出了 晶胞中的
晶胞中的 和位于晶胞体心的
和位于晶胞体心的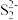 (
(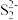 中的
中的 键位于晶胞体对角线上,晶胞中的其他
键位于晶胞体对角线上,晶胞中的其他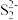 已省略)。如图中用“-”将其中一个S原子与紧邻的
已省略)。如图中用“-”将其中一个S原子与紧邻的 连接起来
连接起来
(3)
 、
、 在空气中易被氧化,将
在空气中易被氧化,将 在空气中氧化,测得氧化过程中剩余固体的质量与起始
在空气中氧化,测得氧化过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。
的质量的比值随温度变化的曲线如图所示。 时,
时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为
您最近半年使用:0次
2022-07-21更新
|
8518次组卷
|
13卷引用:江苏省2022年普通高中学业水平选择性考试
江苏省2022年普通高中学业水平选择性考试(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)2022年江苏卷高考真题变式题14-17(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题三 离子反应-实战高考·二轮复习核心突破北京市第二中学2022-2023学年高三下学期2月开学测试化学试题江苏省南京市金陵中学河西分校2022-2023学年高二上学期期末检测化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(结构与性质)(已下线)2022年北京高考真题化学试题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质北京市第二中学2023-2024学年高三下学期开学考化学试卷
6 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
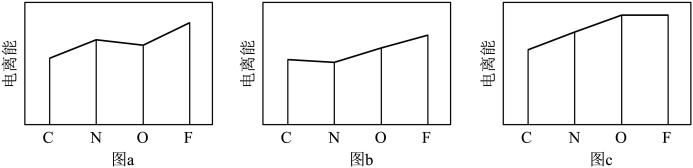
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
(4) CF2=CF2和ETFE分子中C的杂化轨道类型分别为_______ 和_______ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
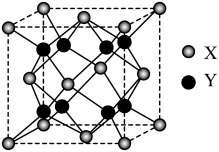
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
(4) CF2=CF2和ETFE分子中C的杂化轨道类型分别为
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是

您最近半年使用:0次
2022-06-08更新
|
18606次组卷
|
21卷引用:2022年高考全国甲卷化学真题
2022年高考全国甲卷化学真题(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(非选择题)重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题17 物质结构与性质综合题-备战2023年高考化学母题题源解密(全国通用)(已下线)专题19 物质结构与性质综合题-备战2023年高考化学母题题源解密(广东卷)河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题云南省部分重点中学2022-2023学年高三上学期月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题福建省2022-2023学年高三上学期化学1月质检考前模拟试题(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
真题
名校
7 . 关于 性质的解释合理的是
性质的解释合理的是
 性质的解释合理的是
性质的解释合理的是| 选项 | 性质 | 解释 |
| A | 比 容易液化 容易液化 |  分子间的范德华力更大 分子间的范德华力更大 |
| B | NH3熔点高于 |  键的键能比 键的键能比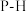 大 大 |
| C | 能与 以配位键结合 以配位键结合 |  中氮原子有孤电子对 中氮原子有孤电子对 |
| D | 氨水中存在 | 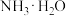 是离子化合物 是离子化合物 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-10-23更新
|
5018次组卷
|
20卷引用:2021年新高考海南化学高考真题
2021年新高考海南化学高考真题2021年海南高考化学试题变式题11-19(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)河南省商丘市五校2021-2022学年高二下学期5月联考化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题广东省华南师范大学附属中学2023届高三上学期第一次月考化学试题(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第三次考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题江苏省南京师范大学附属中学2022-2023学年高一下学期期末考试化学A卷试题(已下线)第3讲 化学键 共价键的类型及键参数(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 分子结构与性质上海市曹杨第二中学2023-2024学年高三上学期期中考试化学试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题北京市十一学校2023-2024学年高一下学期第三学段教学诊断化学试题福建省厦门市湖滨中学2023-2024学年高二下学期期中考试化学试题
8 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
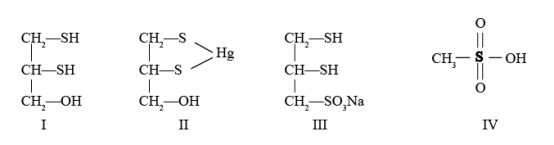
(1)基态硫原子价电子排布式为_______ 。
(2)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(3)汞的原子序数为80,位于元素周期表第_______ 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有_______ 。
A. 在I中S原子采取sp3杂化
B. 在Ⅱ中S元素的电负性最大
C. 在Ⅲ中C-C-C键角是180°
D. 在Ⅲ中存在离子键与共价键
E. 在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是_______ 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb = _______ 。
③设X的最简式的式量为Mr,则X晶体的密度为_______ g/cm3(列出算式)。

(1)基态硫原子价电子排布式为
(2)H2S、CH4、H2O的沸点由高到低顺序为
(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A. 在I中S原子采取sp3杂化
B. 在Ⅱ中S元素的电负性最大
C. 在Ⅲ中C-C-C键角是180°
D. 在Ⅲ中存在离子键与共价键
E. 在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。

①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为Mr,则X晶体的密度为
您最近半年使用:0次
2021-06-11更新
|
11367次组卷
|
16卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题11-21(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习浙江金华第一中学2021-2022学年高一领军班下学期期中考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
9 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:
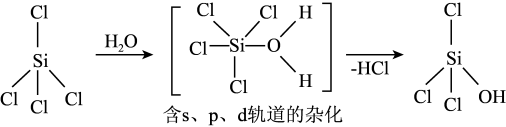
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为a pm、a pm、c pm,该晶体密度为___________ g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________ (用x表达)。

(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近半年使用:0次
2021-06-11更新
|
20780次组卷
|
26卷引用:2021年高考全国甲卷化学真题
2021年高考全国甲卷化学真题北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国甲卷化学试题变式题黑龙江省哈尔滨市第三中学校2021-2022学年高三上学期第四次验收考试理科综合化学试题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习陕西省宝鸡市渭滨区2022届高考模拟(一)化学试题(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题江西省重点校联盟2022-2023学年高三上学期10月联考化学试题天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)第四部分 物质结构与性质 综合提能训练(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)上海市实验学校2023-2024学年高三上学期第一次月考化学试题陕西省渭南市蒲城县尧山中学2023-2024学年高三下学期开学收心考试理综试题-高中化学
真题
解题方法
10 . Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________ ,基态Fe原子的电子排布式为__________ 。
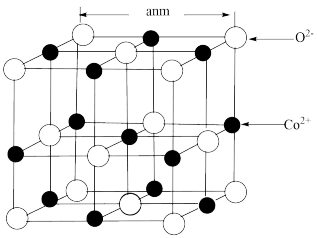
(2)CoO的面心立方晶胞如图所示。设阿伏加 德罗常数的值为NA,则CoO晶体的密度为______ g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______ 。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____ ,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______ 。
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当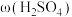 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____ 。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______ (填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______ 。
(1)Fe、Co、Ni在周期表中的位置为
(2)CoO的面心立方晶胞如图所示。设阿伏加 德罗常数的值为NA,则CoO晶体的密度为

(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当
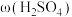 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
您最近半年使用:0次
2020-07-11更新
|
5087次组卷
|
7卷引用:2020年天津卷化学高考试题
2020年天津卷化学高考试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题20 结构与性质



