解题方法
1 . 有机―无机杂化铅卤钙钛矿( )作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。
)作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。
(1)Pb位于第六周期第ⅣA族,其基态原子的价电子排布图为___________ 。
(2) 中涉及的短周期元素的电负性由大到小的顺序为
中涉及的短周期元素的电负性由大到小的顺序为___________ (填元素符号)。沸点:
___________ (填“高于”或“低于”) 。
。
(3)有机阳离子 可通过
可通过 制备,
制备, 中
中 的杂化类型是
的杂化类型是___________ ; 的立体构型为
的立体构型为___________ 。
(4) 的立方晶胞结构如图所示,晶胞中1个
的立方晶胞结构如图所示,晶胞中1个 周围距离最近的
周围距离最近的 数目为
数目为___________ ,已知晶胞边长为 ,
, 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 晶胞的密度为
晶胞的密度为___________ (用含a、 、
、 的代数式表示)
的代数式表示) 。
。

 )作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。
)作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。(1)Pb位于第六周期第ⅣA族,其基态原子的价电子排布图为
(2)
 中涉及的短周期元素的电负性由大到小的顺序为
中涉及的短周期元素的电负性由大到小的顺序为
 。
。(3)有机阳离子
 可通过
可通过 制备,
制备, 中
中 的杂化类型是
的杂化类型是 的立体构型为
的立体构型为(4)
 的立方晶胞结构如图所示,晶胞中1个
的立方晶胞结构如图所示,晶胞中1个 周围距离最近的
周围距离最近的 数目为
数目为 ,
, 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 晶胞的密度为
晶胞的密度为 、
、 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
2 . 元素Fe、Ni、C等形成的各种合金在工业、生活、国防中有很大的作用。
(1)Ni在元素周期表中的位置为________ 。
(2)元素铜与镍的第二电离能:ICu_____ (填“> ”或“< ”)INi,原因是_______ 。
(3)二茂铁是种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+与两个正五边形的环戊二烯负离子(C5H )配体形成的夹心型分子(如图所示),熔点为173℃ (在100 ℃时开始升华),沸点为249 ℃。
)配体形成的夹心型分子(如图所示),熔点为173℃ (在100 ℃时开始升华),沸点为249 ℃。
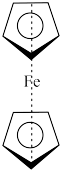
①二茂铁的晶体类型是____ ;1 mol环戊二烯( )分子中含
)分子中含______ molσ键。
②结合二茂铁的结构,预测二茂铁在水中的溶解性并说明理由:________ 。
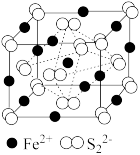
(4)FeS2晶体的晶胞结构如图所示,设晶胞边长为a nm,FeS2的相对分子质量为M,阿伏加 德罗常数的值为NA,则其晶体密度的计算表达式为____________ g·cm-3。
(1)Ni在元素周期表中的位置为
(2)元素铜与镍的第二电离能:ICu
(3)二茂铁是种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+与两个正五边形的环戊二烯负离子(C5H
 )配体形成的夹心型分子(如图所示),熔点为173℃ (在100 ℃时开始升华),沸点为249 ℃。
)配体形成的夹心型分子(如图所示),熔点为173℃ (在100 ℃时开始升华),沸点为249 ℃。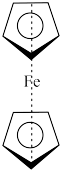
①二茂铁的晶体类型是
 )分子中含
)分子中含②结合二茂铁的结构,预测二茂铁在水中的溶解性并说明理由:
(4)FeS2晶体的晶胞结构如图所示,设晶胞边长为a nm,FeS2的相对分子质量为M,阿伏加 德罗常数的值为NA,则其晶体密度的计算表达式为

您最近一年使用:0次
3 . 全氮阴离子盐是一种新型超高能含能材料,某种全氮阴离子盐结构如图。下列关于该物质的说法正确的是
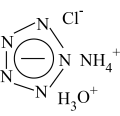

| A.属于有机物 | B.与N2互为同素异形体 |
| C.可用于制造炸药 | D.不含共价键 |
您最近一年使用:0次
解题方法
4 . 电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题,观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
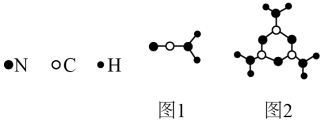
(1)图1中化学键σ键与π键之比为________ ;图2中碳原子的杂化方式为________ 。
(2)在基态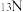 原子中,核外存在
原子中,核外存在_____ 对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____ 形。
(3)碳的最高价含氧酸根的空间构型是__________ ;硝酸的酸性强于亚硝酸的原因是__________ 。
Ⅱ.传统锂电池的主要成分是 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物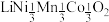 。
。
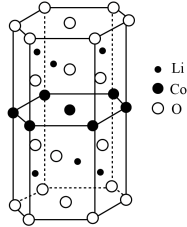
(4)基态 原子的价电子排布式为
原子的价电子排布式为_____________ ;化合物 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________ 。
(5)已知化合物中各原子半径依次为: ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________ (用含有a、b、c、d、e、m、n的式子表示)。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为
(2)在基态
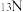 原子中,核外存在
原子中,核外存在(3)碳的最高价含氧酸根的空间构型是
Ⅱ.传统锂电池的主要成分是
 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物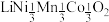 。
。
(4)基态
 原子的价电子排布式为
原子的价电子排布式为 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是(5)已知化合物中各原子半径依次为:
 ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
您最近一年使用:0次
解题方法
5 . 在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________ 。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________ (填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________ ,阳离子中氮的杂化方式为_____________ 。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________ (填分子式),理由是_________________________________________________________________ 。
(5)N、O元素第一电离能的大小关系为__________ (用元素符号表示),原因为____________ 。
(6)铜晶体为面心立方最密堆积,配位数为_____________ ,铜的原子半径为127.8 pm,NA表示阿伏加 德罗常数的值,列出铜晶体的密度计算式:_____________ g·cm-3。
回答下列问题:
(1)基态铜原子的电子排布式为
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为
(4)相同条件下,SO2、CO2在水中的溶解度较大的是
(5)N、O元素第一电离能的大小关系为
(6)铜晶体为面心立方最密堆积,配位数为
您最近一年使用:0次
2020-05-29更新
|
114次组卷
|
2卷引用:辽宁省辽阳市2020届高三第二次模拟考试理综化学试题
解题方法
6 . 铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__ 。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__ 。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__ 。(已知CO32-的结构式为 )
)
③NaNT可以 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为__ 。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___ 。晶胞中离1个Mn原子最近的Ni原子有__ 个。

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__ (列出计算表达式,NA表示阿伏加 德罗常数的数值)g•cm-3。

(1)基态Fe2+的核外电子排布式为
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 )
)③NaNT可以
 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为 中含有σ键的物质的量为
中含有σ键的物质的量为④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为

您最近一年使用:0次
7 . 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________ ,3d能级上的未成对的电子数为______ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供孤电子对的成键原子是_____ 。
③氨的沸点_____ (“高于”或“低于”)膦(PH3),原因是______ ;氨是_____ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 。
(3)单质铜及镍都是由______ 键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。
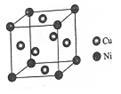
①晶胞中铜原子与镍原子的数量比为_____ 。
②若合金的密度为dg/cm3,晶胞参数a=________ nm。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点
(3)单质铜及镍都是由
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为dg/cm3,晶胞参数a=
您最近一年使用:0次
2016-12-09更新
|
8588次组卷
|
25卷引用:辽宁省辽阳市集美学校2017-2018学年高二3月月考化学试题
辽宁省辽阳市集美学校2017-2018学年高二3月月考化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷宁夏育才中学2016-2017学年高二下学期期末考试化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题云南省河口县第一中学2019届高三上学期期中考试理科综合化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)【全国百强校】宁夏回族自治区吴忠中学2019届高三下学期第一次模拟考试理科综合化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题山东省滨州市惠民县第二中学2018-2019学年高二5月份月考化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题黑龙江省鸡西市鸡东县第二中学2020届高三上学期期中考试化学试题山西省忻州市第一中学2019-2020学年高二下学期期中考试化学试题2020届成都市第七中学高中毕业班四月份教学质量监测卷理科综合化学部分四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题吉林省汪清县第六中学2019-2020学年高二6月月考化学试题黑龙江省大庆市第四中学2020届高三下学期第四次检测理综化学试题宁夏银川市宁夏大学附属中学2021届高三上学期第一次月考化学试题宁夏银川市开元学校2021届高三上学期第三次月考考试化学试题宁夏青铜峡市高级中学2022届高三上学期开学考试化学试题甘肃省嘉峪关市第一中学2021届高三下学期七模考试理综化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题



