名校
解题方法
1 . 普鲁士蓝可用作钠离子电池的正极材料。放电时 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: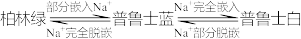 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
 嵌入正极或充电时
嵌入正极或充电时 从正极脱嵌的变化为:
从正极脱嵌的变化为: 。已知三者的通式为
。已知三者的通式为 ,均为立方晶胞,如图1所示。嵌入的
,均为立方晶胞,如图1所示。嵌入的 填充在小立方体的体心,图中
填充在小立方体的体心,图中 均未标出,从普鲁士蓝晶胞中切出
均未标出,从普鲁士蓝晶胞中切出 的结构如图2所示。下列说法错误的是
的结构如图2所示。下列说法错误的是
| A.从结构上分析,基态Fe3+比基态Fe2+相对更稳定 |
B.普鲁士蓝晶胞中 填充率等于50% 填充率等于50% |
| C.图2中σ键和π键的数目之比为3:2 |
| D.普鲁士白的化学式为NaFe2(CN)6 |
您最近一年使用:0次
2023-09-08更新
|
307次组卷
|
2卷引用:辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
2 . 下列说法错误的是
| A.晶体的自范性是晶体中粒子在微观空间呈现周期性的有序排列的宏观表象 |
| B.X射线衍射实验是区分晶体和非晶体最可靠的方法 |
| C.等离子体是一种特殊的液体,由带电的阳离子、电子及电中性粒子的组成 |
| D.液晶既有液体的流动性,又具有类似晶体的各向异性 |
您最近一年使用:0次
2023-09-08更新
|
532次组卷
|
5卷引用:辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题
辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题(已下线)选择题1-5(已下线)第三章晶体结构与性质(B卷)四川省南充高级中学2023-2024学年高二下学期3月月考化学试题
解题方法
3 . 阴离子 和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是
和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是

 和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是
和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是
A. 的空间构型为正四面体 的空间构型为正四面体 |
B.二脲基分子中N-H的H和离 子的O形成氢键 子的O形成氢键 |
| C.所含元素原子的杂化轨道类型均相同 |
| D.所含元素基态原子的第一电离能最大的是N |
您最近一年使用:0次
名校
解题方法
4 . 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式_______ 。
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过______ 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是_______ 。
(3)CuO的熔点比CuCl的熔点_______ (填“高”或“低”)。
(4)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为_______ 。
(5)已知该晶胞参数为bnm,NA为阿伏加德罗常数,则该晶胞密度为_______ g/cm3
(1)写出基态Cu+的核外电子排布式
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过
(3)CuO的熔点比CuCl的熔点
(4)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为

(5)已知该晶胞参数为bnm,NA为阿伏加德罗常数,则该晶胞密度为
您最近一年使用:0次
解题方法
5 . 晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着它们具有不同的性质和用途。几种晶胞的结构示意图如下(石墨仅表示出其中的一层结构):

(1) 、金刚石和石墨三者的关系是互为
、金刚石和石墨三者的关系是互为___________ 。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时, 属于
属于___________ 晶体(填晶体类型)。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有Si-Si单键的数目是___________  。
。
(4)石墨层状结构中,碳原子数与C-C键数之比为___________ 。
(5)观察 分子晶体结构的一部分,试说明每个
分子晶体结构的一部分,试说明每个 分子周围有
分子周围有___________ 个与之紧邻且等距的 分子;该结构单元平均占有
分子;该结构单元平均占有___________ 个 分子。
分子。
(6)观察图形推测,CsCl晶体中每个 周围距离相等且最近的
周围距离相等且最近的 数目为
数目为___________ 个。

(1)
 、金刚石和石墨三者的关系是互为
、金刚石和石墨三者的关系是互为A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,
 属于
属于(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有Si-Si单键的数目是
 。
。(4)石墨层状结构中,碳原子数与C-C键数之比为
(5)观察
 分子晶体结构的一部分,试说明每个
分子晶体结构的一部分,试说明每个 分子周围有
分子周围有 分子;该结构单元平均占有
分子;该结构单元平均占有 分子。
分子。(6)观察图形推测,CsCl晶体中每个
 周围距离相等且最近的
周围距离相等且最近的 数目为
数目为
您最近一年使用:0次
2021-07-20更新
|
205次组卷
|
2卷引用:辽宁省丹东市2020-2021学年高二下学期期末教学质量监测化学试题
名校
6 . 下列有关晶体及配合物结构和性质的判断错误的是
| 选项 | 结构和性质 | 相应判断 |
| A | 贵金属磷化物Rh2P 可用作电解水的高效催化剂,其立方晶胞如图所示 | 该晶体中磷原子的配位数为 8 |
| B | 配离子[Co(NO2)6]3−可用于检验K+的存在 | 该离子中Co3+配位数为 6 |
| C | GaN、GaP、GaAs 都是良好的半导体材料,晶体类型与晶体碳化硅类似 | GaN、GaP、GaAs 的熔点依次升高 |
| D | 氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一 | 分子中存在配位键,提供孤电子对的原子是氮原子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-05更新
|
967次组卷
|
6卷引用:辽宁省丹东市2021届高三下学期3月第一次模拟考试化学试题
辽宁省丹东市2021届高三下学期3月第一次模拟考试化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)湖北省武汉市部分重点中学2020-2021学年高二下学期期中考试化学试题山东省济宁市泗水县2021-2022学年高二下学期期中考试化学试题全书综合测评-苏教版选择性必修2福建省三明第一中学2022-2023学年高二下学期期中考试化学试题
名校
7 . 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。下列说法不正确的
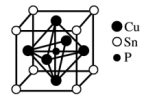

| A.磷锡青铜的化学式为Cu3SnP |
| B.该晶胞中与Sn原子等距离且最近的铜原子有12个 |
| C.该晶体的熔点比金刚砂(SiC)的熔点高 |
| D.磷锡青铜具有各向异性的特点 |
您最近一年使用:0次
2021-03-10更新
|
609次组卷
|
5卷引用:辽宁省丹东市2021届高三下学期期初考试化学试题
名校
8 . X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有 个电子(n表示电子层序数)。请回答下列问题:
个电子(n表示电子层序数)。请回答下列问题:
(1)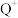 的核外电子排布式为
的核外电子排布式为______ 。
(2)化合物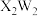 中W的杂化方式为
中W的杂化方式为______ ;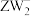 的空间结构为
的空间结构为______ 。
(3)Y、R的最高价氧化物中沸点较高的是______ (填化学式),原因是__________________ 。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为______ ;若晶胞的边长为 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为______ (用含a和ρ的代数式表示)。
 个电子(n表示电子层序数)。请回答下列问题:
个电子(n表示电子层序数)。请回答下列问题:(1)
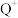 的核外电子排布式为
的核外电子排布式为(2)化合物
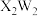 中W的杂化方式为
中W的杂化方式为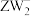 的空间结构为
的空间结构为(3)Y、R的最高价氧化物中沸点较高的是
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为
 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为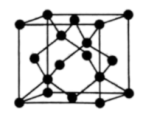
您最近一年使用:0次
2021-02-19更新
|
242次组卷
|
4卷引用:辽宁省丹东市凤城一中2020-2021学年高二下学期4月月考化学试题
10-11高三·安徽黄山·阶段练习
名校
9 . X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
⑴ X位于元素周期表第_______ 族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于__________ 晶体。
⑵ X与Y中电负性较强的是(填元素符号)______ ;XY2的电子式是___________ ,分子中存在_______ 个σ键。
⑶Z2Y2中含有的化学键类型有_____________________ 。阴、阳离子的个数比为______ 。
⑷W的基态原子核外电子排布式是____________________ 。
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:



请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
_________________________________________________________ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 原子最外层电子数是次外层的三倍 |
| Z | 单质及其化合物的焰色反应为黄色 |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
⑵ X与Y中电负性较强的是(填元素符号)
⑶Z2Y2中含有的化学键类型有
⑷W的基态原子核外电子排布式是
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:



请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
您最近一年使用:0次



