名校
1 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
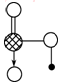
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
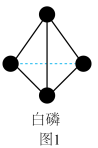
①白磷(P4)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③电负性:P___________ (填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
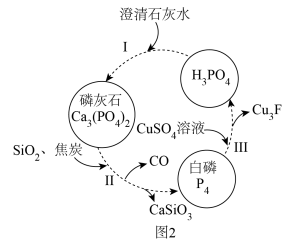
①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知:Cu3P不溶于水)。
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(P4)的相对分子质量为
②基态P原子中成对电子数与未成对电子数之比为
③电负性:P
(2)磷,及其部分重要化合物的相互转化如图2所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为
(3)反应Ⅲ的离子方程式为
您最近一年使用:0次
2024-01-10更新
|
140次组卷
|
2卷引用:辽宁省抚顺市六校协作体2023-2024学年高二上学期期末考试化学试题
解题方法
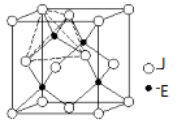
2 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示:
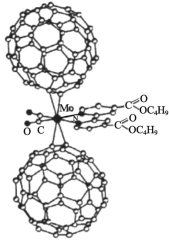
(1)Mo处于第五周期第ⅥB族,价电子排布与Cr相似,它的基态价电子排布图是_____ 。
(2)该超分子中存在的化学键类型有______ (填选项字母)。
A.离子键B.氢键C.σ键D.π键
(3)该超分子中配体CO提供孤电子对的原子是______ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有______ 。
(4)从结构与性质之间的关系解释C60的熔点低于此超分子的原因是________
(5)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。
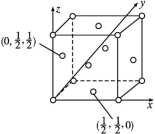
钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(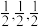 )。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
)。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为______ pm。

(1)Mo处于第五周期第ⅥB族,价电子排布与Cr相似,它的基态价电子排布图是
(2)该超分子中存在的化学键类型有
A.离子键B.氢键C.σ键D.π键
(3)该超分子中配体CO提供孤电子对的原子是
(4)从结构与性质之间的关系解释C60的熔点低于此超分子的原因是
(5)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。

钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(
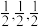 )。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
)。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
您最近一年使用:0次
3 . 不锈钢是由铁、铬 、镍
、镍 、碳、硅及众多不同元素组成的合金。
、碳、硅及众多不同元素组成的合金。
(1)写出碳原子最外层电子的轨道表示式________ ,写出Cr的价电子排布式________ 。
(2)铁和镍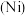 位于周期表的同一周期同一族,写出镍在周期表中的位置
位于周期表的同一周期同一族,写出镍在周期表中的位置__________ 。
(3)下面是工业上冶炼 时会涉及到的反应:
时会涉及到的反应: ____
____
①请将方程式补充完整并配平_______________________
②上述反应中,若转移了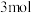 电子,得到的还原产物是
电子,得到的还原产物是____  。
。
③ 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 和NaOH反应的离子方程式
和NaOH反应的离子方程式__________ 。
 、镍
、镍 、碳、硅及众多不同元素组成的合金。
、碳、硅及众多不同元素组成的合金。(1)写出碳原子最外层电子的轨道表示式
(2)铁和镍
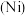 位于周期表的同一周期同一族,写出镍在周期表中的位置
位于周期表的同一周期同一族,写出镍在周期表中的位置(3)下面是工业上冶炼
 时会涉及到的反应:
时会涉及到的反应: ____
____①请将方程式补充完整并配平
②上述反应中,若转移了
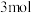 电子,得到的还原产物是
电子,得到的还原产物是 。
。③
 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 和NaOH反应的离子方程式
和NaOH反应的离子方程式
您最近一年使用:0次
名校
解题方法
4 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)Co 属于元素周期表中______ 区元素,其基态原子的价电子排布式为______ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为______ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为______ (用元素符号表示)。
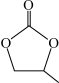
(4)ClO4 -的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______ ,1mol碳酸丙烯酯中 键的数目为
键的数目为______ 。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______ ,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
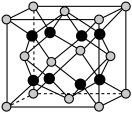
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏加 德罗常数的值为NA,则Na与O之间的最短距离为______ nm(用含ρ、NA的代数式表示)。
(1)Co 属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为
(4)ClO4 -的几何构型为
 键的数目为
键的数目为
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
5 . 黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1) 基态锌原子的核外价电子排布式为_______________ ,属于周期表__________ 区元素。电子占据最高能层的符号是_______________ 占据该能层电子的电子云轮廓图形状为______________
(2)第一电离能I1(Zn)________ I1(Cu)(填“大于”或“小于”)
(3)向蓝色 硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
①下列微粒中与SO42-互为等电子体的是__________ (填序号)。
A.H2SO4 B.CO32- C.PO43- D.CCl4
②H2O分子中心原子的杂化类型为______ ;NH3分子的空间构型为________ 。
分子中的键角:H2O_______ NH3(填“大于”或“小于”)。
③通过上述实验现象可知:与Cu2+与的配位能力H2O_________ NH3 (填“大于”或“小于”)。
④极具应用前景的氨硼烷(BH3·NH3)与乙烷互为等电子体。写出BH3·NH3的结构式(结构中若含配位键用“ ”表示)
”表示)_______________________
(4)金属Cu晶体中的原子堆积方式如图所示,这种堆积方式称为_____________ 。

(5)若Cu晶体的密度为ρg/cm3, 表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离________ nm(不必化简)
(1) 基态锌原子的核外价电子排布式为
(2)第一电离能I1(Zn)
(3)向蓝色
 硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。①下列微粒中与SO42-互为等电子体的是
A.H2SO4 B.CO32- C.PO43- D.CCl4
②H2O分子中心原子的杂化类型为
分子中的键角:H2O
③通过上述实验现象可知:与Cu2+与的配位能力H2O
④极具应用前景的氨硼烷(BH3·NH3)与乙烷互为等电子体。写出BH3·NH3的结构式(结构中若含配位键用“
 ”表示)
”表示)(4)金属Cu晶体中的原子堆积方式如图所示,这种堆积方式称为

(5)若Cu晶体的密度为ρg/cm3,
 表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
表示阿伏加 德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离
您最近一年使用:0次
名校
6 . 人类文明的发展历程,也是化学物质的发现和认识的历程。
(1)基态铁原子的价电子排布图为____ 。
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,l个(SCN)2分子中含有 键的数目为
键的数目为___ 。类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(HNCS)的沸点,其原因是________ 。
(3)硝酸钾中NO3-的空间构型为______ ,写出与NO3-互为等电子体的一种非极性分子的化学式_____ 。
(4)钙的配合物离子[W(CO)5OH]-能催化固定CO2,该配合物离子中钨的配位数是____ 。
(1)基态铁原子的价电子排布图为
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,l个(SCN)2分子中含有
 键的数目为
键的数目为(3)硝酸钾中NO3-的空间构型为
(4)钙的配合物离子[W(CO)5OH]-能催化固定CO2,该配合物离子中钨的配位数是
您最近一年使用:0次
7 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________ 。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________ ,分子中σ键与π键的数目之比为___________ 。醋酸钠中碳原子的杂化类型___________ 。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________ 。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________ 。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________ 。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为
(2)基态Fe3+的核外电子排布式
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为
您最近一年使用:0次
2019-01-24更新
|
1445次组卷
|
4卷引用:【市级联考】辽宁省葫芦岛市普通高中2019届高三下学期第一次模拟考试理综合化学试题
名校
8 . 表是前20号元素中的部分元素的一些数据:
试回答下列问题:
(1)以上10种元素电负性最大的是_____ (填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第____________ ,其基态原子的核外电子排布式是___________ .
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)______ .
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比_________ ;I与氢元素形成的10电子分子X的空间构型为_____ 。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______ ;该晶体中,原子之间的作用力是__________ ;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为___________ 。
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_______________
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为___ ,若晶胞边长为a pm,则晶体的密度为(用含a、NA的代数式表示)________________ (g/mL)。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:

(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为

您最近一年使用:0次
9 . 硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置___________________ ;Se基态原子价电子排布图为_____________ 。元素锌、硫和硒第一电离能较大的是________ (填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______ ;H2SeO4的酸性比H2SeO3强,原因是_______ 。
(3)气态SeO3分子的立体构型为_______ ;下列与SeO3互为等电子体的有_________ (填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______ (填元素符号);该晶胞中硒原子所处空隙类型为_____ (填“立方体”“正四面体”或“正八面体”);若该晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏伽德罗常数的数值,则晶胞参数a为_______ nm。

(1)锌在周期表中的位置
(2)Na2SeO3分子中Se原子的杂化类型为
(3)气态SeO3分子的立体构型为
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为

您最近一年使用:0次
2018-05-10更新
|
371次组卷
|
2卷引用:【校级联考】辽宁省葫芦岛协作校2019届高三上学期第二次考试理科综合化学试题
名校
10 . [化学——选修3:物质结构与性质]X、Y、Z、W、R五种短周期非金属元素原子序数依次增大,X、Y、Z、W为同周期元素且未成对电子数之比为1:2:3:2,R和Z同主族。请回答下列问题:
(1)Z的基态原子的价层电子排布图为______________________________ 。
(2)Z、W、R 三种元素的电负性由大到小的顺序为_____________ (用元素符号表示)。
(3)W的常见氢化物的氢键的键能小于HF氢键的键能,但W的常见氢化物常温下为液态而HF常温下为气态的原因是_______________________________ 。
(4)某种分子式为Y4Z4W8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为_________________________ 。
(5)XR是一种耐磨材料,可由X的三溴化物和R的三溴化物于高温下在氧气的氛围中合成。
①X的三溴化物分子中X原子的杂化方式为_______________ ,R的三溴化物分子的空间构型的名称为_____________________ 。
②合成XR的化学方程式为_____________________ 。
(6)Y与W形成的某种常见化合物的晶胞如图, 该晶体中分子的配位数为
该晶体中分子的配位数为__________________ ,若晶胞的棱长为a nm,阿伏伽德罗常数的值为NA,晶体的密度为______ g/cm3。
(1)Z的基态原子的价层电子排布图为
(2)Z、W、R 三种元素的电负性由大到小的顺序为
(3)W的常见氢化物的氢键的键能小于HF氢键的键能,但W的常见氢化物常温下为液态而HF常温下为气态的原因是
(4)某种分子式为Y4Z4W8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为
(5)XR是一种耐磨材料,可由X的三溴化物和R的三溴化物于高温下在氧气的氛围中合成。
①X的三溴化物分子中X原子的杂化方式为
②合成XR的化学方程式为
(6)Y与W形成的某种常见化合物的晶胞如图,
 该晶体中分子的配位数为
该晶体中分子的配位数为
您最近一年使用:0次



