解题方法
1 . 半导体在集成电路、消费电子、通信系统、光伏发电、照明、大功率电源转换等领域都有应用。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是_______ ,原因是_______ 。硅有晶体硅和无定形硅,可以用_______ (填方法名称)来区分晶体硅和无定形硅。
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,立方砷化硼中,_______ (填“含有”或“不含有”)配位键。
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为_______  ;晶胞密度为
;晶胞密度为_______  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用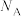 表示)。
表示)。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态
 原子的简化电子排布式为
原子的简化电子排布式为
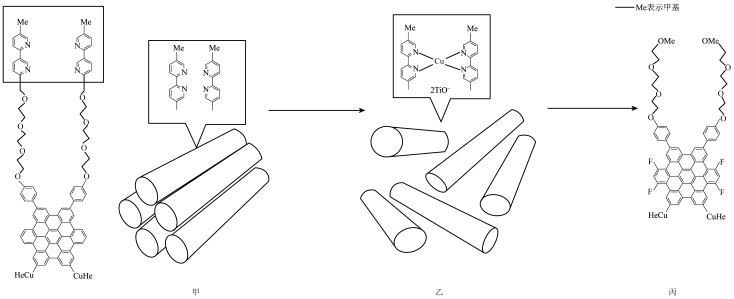
| A.分子识别和自组装是超分子的重要特征 |
B.甲分子中的氮原子的杂化方式均为 |
C.乙分子图示结构部分中,1个 形成了2个配位键 形成了2个配位键 |
| D.丙分子中存在氢键 |
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知
 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为 ;晶胞密度为
;晶胞密度为 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用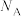 表示)。
表示)。
您最近一年使用:0次
名校
2 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):______ 。
Ⅲ.LiBH4是储氢材料,已知其由Li+和 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的位置______ 。
(5)由元素周期律能得到______。(填序号)
(6)LiBH4中不存在的作用力有______(填序号)。
(7)氢化锂(LiH)是离子化合物。写出其电子式______ ,LiH中负离子半径大于正离子半径,其原因是______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为______ 个。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
| A.C60、Si60、N60分子内部的作用力是共价键 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
Ⅲ.LiBH4是储氢材料,已知其由Li+和
 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。(4)锂位于元素周期表的位置
(5)由元素周期律能得到______。(填序号)
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.沸点:H2O大于HF | D.酸性:HCl大于H2SO3 |
(6)LiBH4中不存在的作用力有______(填序号)。
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(7)氢化锂(LiH)是离子化合物。写出其电子式
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
您最近一年使用:0次
解题方法
3 . 刀片电池(The blade battery)是比亚迪于2020年3月29日发布的电池产品。正极材料使用了磷酸亚铁锂( ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: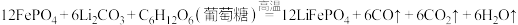 。回答下列问题:
。回答下列问题:
(1)Li位于元素周期表的_____ 区,基态Fe原子的价电子排布式为_________ 。
(2)同周期元素中,第一电离能大于O的原子是_______ 。
(3)有关 叙述正确的是___________。
叙述正确的是___________。
(4) 的空间结构为
的空间结构为______ ,其中P采取____ 杂化方式。
(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是______ ,解释易溶于水的原因_______ 。
 ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: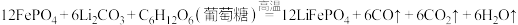 。回答下列问题:
。回答下列问题:(1)Li位于元素周期表的
(2)同周期元素中,第一电离能大于O的原子是
(3)有关
 叙述正确的是___________。
叙述正确的是___________。A.分子中 键和 键和 键个数比为1:1 键个数比为1:1 | B.含有极性键的非极性分子 |
C.分子空间结构与 相同 相同 | D.熔点、沸点高于 |
 的空间结构为
的空间结构为(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是
您最近一年使用:0次
2024-01-13更新
|
224次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二上学期1月期末化学试题
解题方法
4 . 氯化铍(BeO)高温下导热性能良好,具有一定的防核辐射作用,常用于制合金、催化剂和耐火材料等。利用金绿宝石共生矿(主要成分是BeAl2O4,含少量铁的氧化物、石英)制备氧化铍和副产品铵明矾 的工艺流程如下:
的工艺流程如下:

已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“熔炼”的作用是___________ 。
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:___________ 。①充分反应,提高浸出率;②____________ 。
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:
__________ ↑+__________  。
。
(4)“氧化”时加入H2O2的目的是___________ 。“调pH”的范围是________ 。
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为_______________ 。
②若晶胞参数为anm,设阿伏加德罗常数的值为 ,则BeO晶体的密度
,则BeO晶体的密度
________ g·cm-3。
 的工艺流程如下:
的工艺流程如下:
已知:①当金绿宝石与其他矿石共生时,形成的结构不易溶于硫酸。
②该工艺中,溶液中金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Be2+ |
| 开始沉淀pH | 1.5 | 3.3 | 6.5 | 5.2 |
| 完全沉淀pH | 3.7 | 5.0 | 9.7 | 8.8 |
(1)“熔炼”的作用是
(2)“酸浸”时,BeAl2O4发生反应的离子方程式是加入过量硫酸的作用是:
(3)“结晶”时可获得铵明矾,将铵明矾脱水后进一步热分解可获得高纯氧化铝,完成反应的化学方程式:

 。
。(4)“氧化”时加入H2O2的目的是
(5)BeO的立方晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,若W原子的坐标为(0,0,0),则1号原子的坐标为
②若晶胞参数为anm,设阿伏加德罗常数的值为
 ,则BeO晶体的密度
,则BeO晶体的密度
您最近一年使用:0次
5 . 氢能备受人们的关注,储氢材料的研究对于氢能的储运和开发具有重要意义。回答下列问题:
Ⅰ.储氢材料氨硼烷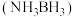 储氢容量高,常温常压下为白色晶体,熔点
储氢容量高,常温常压下为白色晶体,熔点 ,易溶于水。
,易溶于水。
(1) 晶体的晶体类型为
晶体的晶体类型为___________ 晶体。
(2) 易溶于水的主要原因是
易溶于水的主要原因是___________ 。
(3) 中
中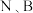 都达到稳定结构,
都达到稳定结构, 分子的结构式为
分子的结构式为___________ (用“ ”表示配位键)。
”表示配位键)。
Ⅱ.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。 原子位于
原子位于 原子构成的
原子构成的___________ 面体空隙中。
(5)铁镁合金的化学式为___________ 。
(6)若该晶胞的边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该合金的密度为
,则该合金的密度为___________  (用含
(用含 的表达式表示)。
的表达式表示)。
(7)若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含
分子在晶胞的体心和棱心位置,则含 的该储氢合金可储存
的该储氢合金可储存 (标准状况)的体积约为
(标准状况)的体积约为___________ L。
Ⅰ.储氢材料氨硼烷
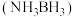 储氢容量高,常温常压下为白色晶体,熔点
储氢容量高,常温常压下为白色晶体,熔点 ,易溶于水。
,易溶于水。(1)
 晶体的晶体类型为
晶体的晶体类型为(2)
 易溶于水的主要原因是
易溶于水的主要原因是(3)
 中
中 都达到稳定结构,
都达到稳定结构, 分子的结构式为
分子的结构式为 ”表示配位键)。
”表示配位键)。Ⅱ.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
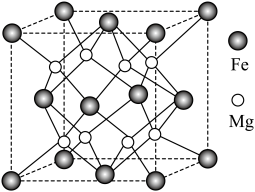
 原子位于
原子位于 原子构成的
原子构成的(5)铁镁合金的化学式为
(6)若该晶胞的边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该合金的密度为
,则该合金的密度为 (用含
(用含 的表达式表示)。
的表达式表示)。(7)若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含
分子在晶胞的体心和棱心位置,则含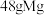 的该储氢合金可储存
的该储氢合金可储存 (标准状况)的体积约为
(标准状况)的体积约为
您最近一年使用:0次
名校
6 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型分子Ⅳ的合成路线如下:

(1)Se与S同族,基态硒原子价电子排布式为_______ ,硒元素位于元素周期表的_______ 区。
(2)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有_______ 。
a.Ⅰ中仅有σ键
b.Ⅰ中的Se—Se键为非极性共价键
c.Ⅱ易溶于水
d.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
e.Ⅰ~Ⅲ含有的元素中,O电负性最大
(3)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。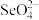 的空间构型为
的空间构型为_______ 。
(4)化合物X是某种潜在材料,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为_______ 。
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为_______ nm(列出计算式,NA为阿伏加德罗常数的值)。
(5)烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为_______ (填序号)。
a. b.
b.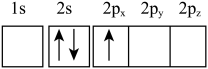 c.
c. d.
d. 

(1)Se与S同族,基态硒原子价电子排布式为
(2)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
a.Ⅰ中仅有σ键
b.Ⅰ中的Se—Se键为非极性共价键
c.Ⅱ易溶于水
d.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
e.Ⅰ~Ⅲ含有的元素中,O电负性最大
(3)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。
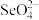 的空间构型为
的空间构型为(4)化合物X是某种潜在材料,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为M,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为
(5)烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为
a.
 b.
b. c.
c. d.
d. 
您最近一年使用:0次
解题方法
7 . 氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

(1)教材中介绍的金刚石的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为_______ 形,立方相氮化硼晶体中,一个B与最近N之间有4个键,而B原子最外层中只有3个电子,推测其中可能有一个键为_______ 键。
(4) (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有_______ mol配位键。
(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有_______ 个N原子、_______ 个B原子。晶胞参数为a pm,则晶体的密度为_______  (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: )。
)。

(1)教材中介绍的金刚石的碳原子呈
 ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈 ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中均不含有离子键 |
| D.两种晶体均为分子晶体 |
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为
(4)
 (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有
 (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: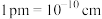 )。
)。
您最近一年使用:0次
解题方法
8 . 铜单质及其化合物在很多领域有重要的用途。
(1)铜单质属于_______ 晶体,铜晶胞如图I所示,一个铜晶胞含有_______ 个铜原子;铜和氧形成的一种离子化合物的晶体结构如图Ⅱ,则化合物中铜元素的化合价为_______ 。

(2)配合物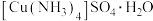 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是_______ (填化学式),配体是_______ (填化学式),配位数为_______ , 中的N
中的N_______ (填“给出”或“接受”)孤电子对。
(3) 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈_______ 形,n=_______ 。
(4) 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):

①乙二胺和三甲胺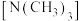 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:_______ 。
②配合物 中不存在的作用力类型有
中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
(1)铜单质属于

(2)配合物
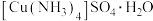 是深蓝色晶体,在配合物的配离子
是深蓝色晶体,在配合物的配离子 中,中心离子是
中,中心离子是 中的N
中的N(3)
 与
与 形成的配合物可表示成
形成的配合物可表示成 ,该配合物中,
,该配合物中, 的4s轨道及4p轨道通过sp杂化与
的4s轨道及4p轨道通过sp杂化与 成键,则
成键,则 中
中 与n个氮原子的空间结构呈
与n个氮原子的空间结构呈(4)
 与乙二胺(
与乙二胺( )可形成配离子
)可形成配离子 (En是乙二胺的简写):
(En是乙二胺的简写):
①乙二胺和三甲胺
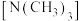 均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:
均属于胺,但乙二胺比三甲胺的沸点高得多,不考虑相对分子质量的影响,其原因是:②配合物
 中不存在的作用力类型有
中不存在的作用力类型有A.配位键 B.极性键 C.离子键
D.非极性键 E.范德华力 F.金属键
您最近一年使用:0次
解题方法
9 . 硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于_______ 晶体, 属于
属于_______ 晶体,石墨属于_______ 晶体,它们都是碳元素的_______ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以 为代表,结构如下图。
为代表,结构如下图。
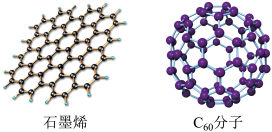
从石墨中剥离得到石墨烯需克服的作用是_______ ;在石墨烯中,每个六元环占有_______ 个C原子。1mol  分子中σ键数为
分子中σ键数为_______ (用 表示)。
表示)。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):_______ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:_______ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 )的△H=
)的△H=_______ kJ/mol。
(1)金刚石属于
 属于
属于(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以
 为代表,结构如下图。
为代表,结构如下图。
从石墨中剥离得到石墨烯需克服的作用是
 分子中σ键数为
分子中σ键数为 表示)。
表示)。(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能kJ/mol | 360 | 436 | 431 | 176 |
 )的△H=
)的△H=
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是___________ 。气态三氧化硫以单分子形式存在,其分子的空间结构为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。

(2)分子中的大π键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为___________ 。SO2分子中键角∠OSO___________  中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。
(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为___________ 。下图中表示的碳原子能量最高的是___________ (填字母)。
A. B.
B.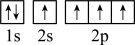
C. D.
D.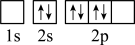
(4)三甲胺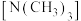 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是___________ 。C60的熔点比金刚石、石墨熔点低的原因是___________ 。
(5)在冰晶体中除氢键外,还存在范德华力 。已知冰的升华热是
。已知冰的升华热是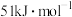 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少___________  。
。
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是

(2)分子中的大π键可用符号
 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为 中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为A.
 B.
B.
C.
 D.
D.
(4)三甲胺
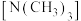 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(5)在冰晶体中除氢键外,还存在范德华力
 。已知冰的升华热是
。已知冰的升华热是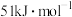 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少 。
。
您最近一年使用:0次



