名校
1 . 过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是______(填标号)。
(2) 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。
①该配位化合物中心离子的价层电子排布式为______ ,中心离子的配位数为______ 。
②该配位化合物中含氮离子的中心原子的杂化类型为______ 。
(3)① 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是______ 。
②已知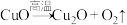 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因______ 。
(4) 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为______ g( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)下列有关说法正确的是______(填标号)。
| A.铜元素焰色试验的光谱为吸收光谱 |
| B.金属键没有方向性和饱和性 |
| C.基态铁原子核外未成对电子有4个 |
| D.锌属于过渡元素,处于元素周期表的d区 |
 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。①该配位化合物中心离子的价层电子排布式为
②该配位化合物中含氮离子的中心原子的杂化类型为
(3)①
 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是②已知
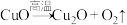 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因(4)
 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。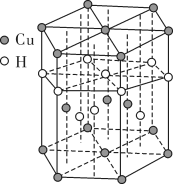
您最近一年使用:0次
名校
2 . 钛被称为继铁、铝之后的“第三金属”。一种制备金属钛的工艺流程如下所示:___________ 。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与CCl4相似。试预测CCl4的沸点___________ 136℃(填“>”“<”或“=”)并阐述推测理由___________ 。
(3)纳米TiO2是一种应用广泛的催化剂,其催化作用的一个实例如下所示:___________ 。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,该阳离子的结构片段如图所示。该阳离子中Ti与O的原子数之比为___________ 。___________ g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。

(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与CCl4相似。试预测CCl4的沸点
(3)纳米TiO2是一种应用广泛的催化剂,其催化作用的一个实例如下所示:

(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,该阳离子的结构片段如图所示。该阳离子中Ti与O的原子数之比为


您最近一年使用:0次
2024-05-05更新
|
124次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
解题方法
3 . 铁和硒(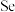 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)比较键角大小:气态 分子
分子_____ 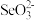 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_____ 。
(2)富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:

富马酸分子中 键与
键与 键的数目比为
键的数目比为_____ ;
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将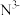 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:

产物中N原子的杂化轨道类型为_____ ;
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为_____ ;
②Fe原子的配位数为_____ ;
③该晶胞参数 、
、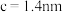 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_____  (列出计算式)。
(列出计算式)。
 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)比较键角大小:气态
 分子
分子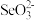 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁
 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
富马酸分子中
 键与
键与 键的数目比为
键的数目比为(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将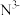 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
产物中N原子的杂化轨道类型为
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数
 、
、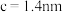 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。___________ 。
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为( )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为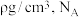 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ 。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

①铁、铝金属间化合物的化学式为
 )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标②则该立方晶胞的密度为
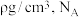 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次
名校
5 . 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通信等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为______ ;与硒同周期的p区元素中第一电离能大于硒的元素有______ 种;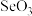 的空间结构是
的空间结构是______ 。
(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______ 。硅与氢结合能形成一系列的二元化合物 、
、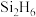 等,与氯、溴结合能形成
等,与氯、溴结合能形成 、
、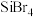 ,上述四种物质沸点由高到低的顺序为
,上述四种物质沸点由高到低的顺序为______ ,丁硅烯( )中
)中 键与
键与 键个数之比为
键个数之比为______ 。
(3)GaN、GaP、GaAs都是共价晶体,熔点如下表所示,分析其熔点变化的原因:______ 。
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为
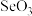 的空间结构是
的空间结构是(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
 、
、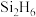 等,与氯、溴结合能形成
等,与氯、溴结合能形成 、
、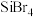 ,上述四种物质沸点由高到低的顺序为
,上述四种物质沸点由高到低的顺序为 )中
)中 键与
键与 键个数之比为
键个数之比为(3)GaN、GaP、GaAs都是共价晶体,熔点如下表所示,分析其熔点变化的原因:
| 晶体 | GaN | GaP | GaAs |
| 熔点 | 1700℃ | 1480℃ | 1238℃ |
您最近一年使用:0次
名校
解题方法
6 . 超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知: 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。

(1) 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是___________ (填标号)。
A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C. 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快
(2) 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。
①基态 的核外电子空间运动状态有
的核外电子空间运动状态有___________ 种。
② 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为___________ ,该晶体密度为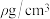 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ pm。

(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠( )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。
①样品中铁元素的质量分数为___________ %。
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为___________ 。
已知:
 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
(1)
 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C.
 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快(2)
 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。①基态
 的核外电子空间运动状态有
的核外电子空间运动状态有②
 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为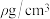 ,则该晶胞的棱长为
,则该晶胞的棱长为
(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠(
 )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。①样品中铁元素的质量分数为
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为
您最近一年使用:0次
解题方法
7 . 刀片电池(The blade battery)是比亚迪于2020年3月29日发布的电池产品。正极材料使用了磷酸亚铁锂( ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: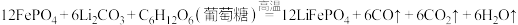 。回答下列问题:
。回答下列问题:
(1)Li位于元素周期表的_____ 区,基态Fe原子的价电子排布式为_________ 。
(2)同周期元素中,第一电离能大于O的原子是_______ 。
(3)有关 叙述正确的是___________。
叙述正确的是___________。
(4) 的空间结构为
的空间结构为______ ,其中P采取____ 杂化方式。
(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是______ ,解释易溶于水的原因_______ 。
 ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: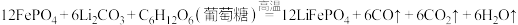 。回答下列问题:
。回答下列问题:(1)Li位于元素周期表的
(2)同周期元素中,第一电离能大于O的原子是
(3)有关
 叙述正确的是___________。
叙述正确的是___________。A.分子中 键和 键和 键个数比为1:1 键个数比为1:1 | B.含有极性键的非极性分子 |
C.分子空间结构与 相同 相同 | D.熔点、沸点高于 |
 的空间结构为
的空间结构为(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是
您最近一年使用:0次
2024-01-13更新
|
224次组卷
|
2卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含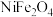 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应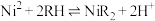 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料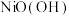 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
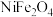 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
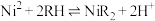 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料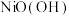 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
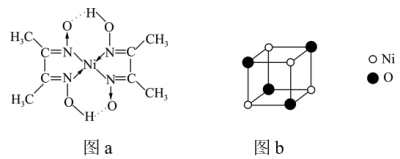
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
名校
解题方法
9 . 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为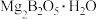 ,硼砂的化学式为
,硼砂的化学式为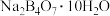 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:

已知: 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为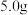 、
、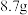 、
、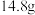 、
、 。
。
(1)B原子的电子排布式为________ 。
(2)硼砂溶于热水后,常用 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是________________________________________________ 。
(3)X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________________ 。
(4) 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是__________ 。
(5)已知硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是_______ 。

已知硼酸在水中电离产生 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是________ (填标号)。
A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.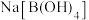 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中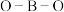 的键角相同
的键角相同
(6)制得的粗硼在一定条件下生成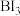 ,
,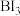 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的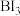 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为________ (提示: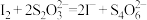 )
)
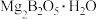 ,硼砂的化学式为
,硼砂的化学式为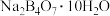 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
已知:
 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为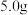 、
、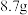 、
、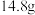 、
、 。
。(1)B原子的电子排布式为
(2)硼砂溶于热水后,常用
 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是(3)X为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(4)
 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是(5)已知硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
已知硼酸在水中电离产生
 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.
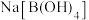 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中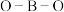 的键角相同
的键角相同(6)制得的粗硼在一定条件下生成
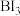 ,
,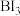 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的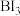 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为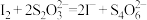 )
)
您最近一年使用:0次
名校
解题方法
10 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
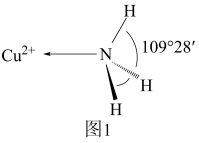
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是___________ 。
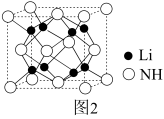
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-07-07更新
|
84次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期10月月考化学试题



