解题方法
1 . 钛、铜、锌及其化合物在生产生活中有着广泛的应用,回答下列问题:
(1)基态铜原子的价电子排布式_______ ;元素铜和锌的第二电离能: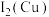
_______  (填“>”、“>”或“=”)
(填“>”、“>”或“=”)
(2)硫酸铜溶于氨水可形成 络合物。
络合物。 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ ,阴离子的立体构型为_______ ;1mol 中含有
中含有 键的数目为
键的数目为_______ 。
(3)钛与卤素形成的化合物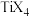 熔点如表,则
熔点如表,则 的熔点比
的熔点比 高的原因可能是
高的原因可能是_______ 。
(4)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:则组成R的元素中,除Ti之外元素的电负性从大到小的顺序是_______ (填元素符号)。

(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_______ ;若该晶胞边长为a pm,NA代表阿伏加德罗常数的值,则晶胞密度为_______  。
。

(1)基态铜原子的价电子排布式
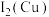
 (填“>”、“>”或“=”)
(填“>”、“>”或“=”)(2)硫酸铜溶于氨水可形成
 络合物。
络合物。 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 中含有
中含有 键的数目为
键的数目为(3)钛与卤素形成的化合物
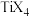 熔点如表,则
熔点如表,则 的熔点比
的熔点比 高的原因可能是
高的原因可能是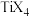 |  |  |  |  |
| 熔点℃ | 377 | ―24 | 38.3 | 153 |
(4)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:则组成R的元素中,除Ti之外元素的电负性从大到小的顺序是

(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 。
。
您最近一年使用:0次
解题方法
2 .  是制作超细铜粉的原料,回答下列问题:
是制作超细铜粉的原料,回答下列问题:
(1) 中Cu显+1价,其价电子排布图为
中Cu显+1价,其价电子排布图为_______ ,核外电子有_______ 种空间运动状态。
(2)N、O、S第一电离能由大到小的顺序是_______ (用元素符号表示)。研究发现,它们简单氢化物的沸点按 、
、 、
、 依次降低,出现这一现象的原因是
依次降低,出现这一现象的原因是_______ 。
(3) 的空间构型为
的空间构型为_______ (写名称),写出一种与 互为等电子体的分子的化学式
互为等电子体的分子的化学式_______ 。
(4)超细铜粉与钙可形成储氢合金 ,晶胞结构如图所示。已知储氢后氢进入晶胞空隙,晶胞体积不变,形成合金
,晶胞结构如图所示。已知储氢后氢进入晶胞空隙,晶胞体积不变,形成合金 。则
。则 中n=
中n=_______ (填数值);储氢后合金的密度增加了_______ %(填数值)。

 是制作超细铜粉的原料,回答下列问题:
是制作超细铜粉的原料,回答下列问题:(1)
 中Cu显+1价,其价电子排布图为
中Cu显+1价,其价电子排布图为(2)N、O、S第一电离能由大到小的顺序是
 、
、 、
、 依次降低,出现这一现象的原因是
依次降低,出现这一现象的原因是(3)
 的空间构型为
的空间构型为 互为等电子体的分子的化学式
互为等电子体的分子的化学式(4)超细铜粉与钙可形成储氢合金
 ,晶胞结构如图所示。已知储氢后氢进入晶胞空隙,晶胞体积不变,形成合金
,晶胞结构如图所示。已知储氢后氢进入晶胞空隙,晶胞体积不变,形成合金 。则
。则 中n=
中n=
您最近一年使用:0次
解题方法
3 . 微量元素指的是在人体中含量低于人体质量0.005%~0.01%的元素,包括Fe、I、Zn、Se、F、Cu、Co、Si等。
(1)F元素的基态原子核外有___ 个未成对电子,基态Fe原子的价电子排布式为____ 。
(2) 为四面体结构,其中Si原子采取的杂化类型为
为四面体结构,其中Si原子采取的杂化类型为_______ 。与 不同,
不同, 的立体构型为
的立体构型为_______ 。
(3)第一电离能Cu小于Zn,理由是_______ 。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是_______ 。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO熔点较高的原因:_______ 。
(5)ZnO晶体存在多种结构,其中某种常见的晶胞结构(如图)。其晶胞边长为anm,阿伏加德罗常数的值为NA,则晶胞密度为_______ (列出计算式)g·cm-3

(1)F元素的基态原子核外有
(2)
 为四面体结构,其中Si原子采取的杂化类型为
为四面体结构,其中Si原子采取的杂化类型为 不同,
不同, 的立体构型为
的立体构型为(3)第一电离能Cu小于Zn,理由是
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(5)ZnO晶体存在多种结构,其中某种常见的晶胞结构(如图)。其晶胞边长为anm,阿伏加德罗常数的值为NA,则晶胞密度为

您最近一年使用:0次
名校
解题方法
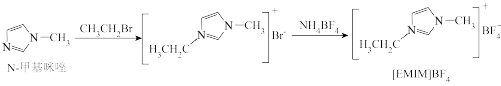
4 . 离子液体是在室温附近温度下呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。直到1992年,威尔克斯(J.Wilkes)以无色液体N-甲基咪唑为原料,合成了稳定性强、抗水解的[ EMIM]BF4离子液体后,对离子液体的研究才真正广泛开展起来,[EMIM]BF4离子液体合成路线如下。
(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是_______ 。
(2)离子液体[ EMIM]BF4阴离子的空间构型为_______ ,基态F原子的核外电子空间运动状态有_______ 种。
(3)离子液体在室温下为液体的主要原因是_______ 。
(4)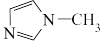 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为_______ ,分子中的大π键可用符号π 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。
(5)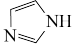 是
是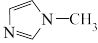 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较: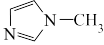
_______ 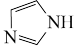 (填>、<或=) ,原因是
(填>、<或=) ,原因是_______ 。
(6)下列说法正确的是_______( 填字母)
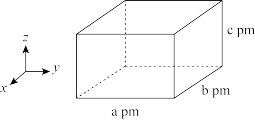
(7)[ EMIM]BF4晶胞结构如图所示,晶胞参数为a pm,b pm,c pm以及90°,90° ,90°。已知其晶胞中有8个N原子,以M表示[ EMIM]BF4的相对分子质量,NA表示阿伏加德罗常数的值,晶体的密度为_______ g/cm-3。

(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是
(2)离子液体[ EMIM]BF4阴离子的空间构型为
(3)离子液体在室温下为液体的主要原因是
(4)
 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。(5)
 是
是 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较:
 (填>、<或=) ,原因是
(填>、<或=) ,原因是(6)下列说法正确的是_______( 填字母)
A.1mol 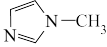 有12molσ键 有12molσ键 |
| B.[EMIM]BF4的的合成路线中所有反应物C原子的杂化形式保持不变,且均为sp3杂化 |
| C.[EMIM] BF4的合成路线中所有反应物N原子的杂化形式保持不变 |
| D.[EMIM] BF4晶体中存在共价键、离子键、范德华力和氢键等相互作用力 |

您最近一年使用:0次
2022-07-01更新
|
168次组卷
|
2卷引用:广西四市玉林市普通高中2022届高三下学期4月教学质量监测考试理科综合化学试题
解题方法
5 . 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)基态Fe原子有_______ 个未成对电子,Fe3+的电子排布式为_______ 。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C =S)。
①写出与SCN-互为等电子体的一种微粒_______ (分子或离子);
②硫氰酸分子中C原子的杂化方式为_______ 。
③异硫氰酸的沸点比硫氰酸沸点高的原因是_______ 。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于所有面心和顶点,则该晶胞中有_______ 个铜原子
(4)Al单质为面心立方晶体,其晶胞参数a= 0.405 nm,晶胞中铝原子的配位数为_______ ,列式表示Al单质的密度_______ g·cm-3.
(1)基态Fe原子有
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C =S)。
①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中C原子的杂化方式为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是
(4)Al单质为面心立方晶体,其晶胞参数a= 0.405 nm,晶胞中铝原子的配位数为
您最近一年使用:0次
名校
解题方法
6 . 钛、锌、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。铁的基态原子价电子排布式为_______ 。
(2)黄铜是人类最早使用的合金之一,主要由 和
和 组成。第一电离能I1(Zn)
组成。第一电离能I1(Zn) _______ I1(Cu) (填“大于”或“小于”)。原因是_______ 。
(3)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为
中,阴离子空间构型为_______ , 原子的杂化形式为
原子的杂化形式为_______ 。
(4) 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知 遇邻苯二酚(
遇邻苯二酚(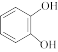 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是_______ ;已知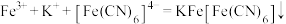 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中
中 键、
键、 键数目之比为
键数目之比为_______ 。
(5) 和
和 的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
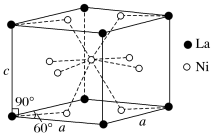
①该晶体的化学式为_______ 。
②已知该晶胞的摩尔质量为 ,密度为
,密度为 。设
。设 为阿伏加德罗常数的值,则该晶胞的边长是
为阿伏加德罗常数的值,则该晶胞的边长是_______  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。铁的基态原子价电子排布式为
(2)黄铜是人类最早使用的合金之一,主要由
 和
和 组成。第一电离能I1(Zn)
组成。第一电离能I1(Zn) (3)《中华本草》等中医典籍中,记载了炉甘石(
 )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为
中,阴离子空间构型为 原子的杂化形式为
原子的杂化形式为(4)
 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知 遇邻苯二酚(
遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是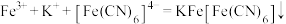 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中
中 键、
键、 键数目之比为
键数目之比为(5)
 和
和 的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为
②已知该晶胞的摩尔质量为
 ,密度为
,密度为 。设
。设 为阿伏加德罗常数的值,则该晶胞的边长是
为阿伏加德罗常数的值,则该晶胞的边长是 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-05-31更新
|
358次组卷
|
2卷引用:广西河池市八校2021-2022学年高二下学期第二次联考化学试题
2022·江苏·模拟预测
名校
解题方法
7 . 由铁及其化合物可制得FeSO4·7H2O、FeCl3、K2FeO4等化工产品,它们在生产、生活中具有广泛应用。已知NO能被FeSO4溶液吸收生成配合物 。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5kJ·mol-1。下列有关说法不正确的是
。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5kJ·mol-1。下列有关说法不正确的是

 。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5kJ·mol-1。下列有关说法不正确的是
。高炉炼铁的反应为 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-23.5kJ·mol-1。下列有关说法不正确的是
| A.如图所示γ-Fe的晶胞中,铁原子的配位数为12 |
B.配离子为 ,配位数为6 ,配位数为6 |
| C.H2O分子是含有极性键的非极性分子 |
| D.该配合物中阴离子空间构型为正四面体形 |
您最近一年使用:0次
名校
解题方法
8 . VA族元素及其化合物在材料等方面有重要用途。根据所学知识回答下列问题:
(1)基态砷原子处于最高能级的电子云轮廓图为_______ 形。
(2)NH3、PH3、AsH3是同主族元素的氢化物,其中键角最小的是_______ 。
(3)叠氮化钠(NaN3)用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(HN3,结构可视为H-N=N≡N),则叠氮酸中3个氮原子的杂化类型分别为_______ (不分先后)。
(4)N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为_______ 。
(5)Na3AsO4可用作杀虫剂,AsO 的立体构型为
的立体构型为_______ ,与其互为等电子体的分子的化学式为_______ (任写一种)。
(6)磷的一种同素异形体为白磷(P4),推测白磷在CS2中的溶解度_______ (填“大于”、“小于”或“等于”)其在水中的溶解度。
(7)HgCl2和不同浓度NH3—NH4Cl反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个Hg原子均处于小立方体的面心)
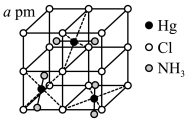
写出该含汞化合物的化学式_______ 。则该晶体的密度ρ=_______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)。
(1)基态砷原子处于最高能级的电子云轮廓图为
(2)NH3、PH3、AsH3是同主族元素的氢化物,其中键角最小的是
(3)叠氮化钠(NaN3)用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(HN3,结构可视为H-N=N≡N),则叠氮酸中3个氮原子的杂化类型分别为
(4)N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为
(5)Na3AsO4可用作杀虫剂,AsO
 的立体构型为
的立体构型为(6)磷的一种同素异形体为白磷(P4),推测白磷在CS2中的溶解度
(7)HgCl2和不同浓度NH3—NH4Cl反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个Hg原子均处于小立方体的面心)

写出该含汞化合物的化学式
您最近一年使用:0次
2022-05-08更新
|
302次组卷
|
2卷引用:广西壮族自治区桂林市、梧州市2022届高三联合调研考试(一模)理综化学试题
名校
解题方法
9 . 铁、铜、锌都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
(1)基态铁原子核外价电子排布式为_______ ;基态Zn原子核外占据最高能层电子的电子云轮廓图形状为_______ 。
(2)已知铜的配合物A的结构如图所示。

①该配合物中 的配位数为
的配位数为_______ 。
②该配合物中的第二周期元素的第一电离能由小到大的顺序为_______ 。
③配体氨基乙酸根(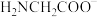 )受热分解可产生
)受热分解可产生 和
和 ,
, 的VSEPR模型名称为
的VSEPR模型名称为_______ 。
(3)铁和氮可形成一种晶体,晶胞结构如图所示,则该晶体的化学式为_______ ,若该晶体的密度为 ,用NA表示阿伏加德罗常数的值,则该晶胞的体积是
,用NA表示阿伏加德罗常数的值,则该晶胞的体积是_______  。
。

(1)基态铁原子核外价电子排布式为
(2)已知铜的配合物A的结构如图所示。

①该配合物中
 的配位数为
的配位数为②该配合物中的第二周期元素的第一电离能由小到大的顺序为
③配体氨基乙酸根(
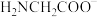 )受热分解可产生
)受热分解可产生 和
和 ,
, 的VSEPR模型名称为
的VSEPR模型名称为(3)铁和氮可形成一种晶体,晶胞结构如图所示,则该晶体的化学式为
 ,用NA表示阿伏加德罗常数的值,则该晶胞的体积是
,用NA表示阿伏加德罗常数的值,则该晶胞的体积是 。
。
您最近一年使用:0次



