1 . 回答下列问题:
(1)①基态Ni原子价层电子的电子排布图为_______ 。
②含有4个水分子的醋酸镍[Ni(C2H3O2)2·4H2O]构型为八面体,则中心Ni原子的配位数为_______ 。
(2)富马酸 结构中,碳原子的杂化类型是
结构中,碳原子的杂化类型是_______ ,其中元素的电负性由大到小排序为_______ 。
(3)NaBH4是有机合成中常用的还原剂,BH 离子的空间构型为
离子的空间构型为_______ ,与BH 互为等电子体的一种阳离子为
互为等电子体的一种阳离子为_______ (填离子符号), NaBH4中存在_______ (填字母)。
A.离子键 B.σ键 C. π键 D.氢键
(4)OF2的熔、沸点低于Cl2O,原因是_______ 。
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______ g/cm3
②图乙TiO2-aNb晶体中a=_______ 。
(1)①基态Ni原子价层电子的电子排布图为
②含有4个水分子的醋酸镍[Ni(C2H3O2)2·4H2O]构型为八面体,则中心Ni原子的配位数为
(2)富马酸
 结构中,碳原子的杂化类型是
结构中,碳原子的杂化类型是(3)NaBH4是有机合成中常用的还原剂,BH
 离子的空间构型为
离子的空间构型为 互为等电子体的一种阳离子为
互为等电子体的一种阳离子为A.离子键 B.σ键 C. π键 D.氢键
(4)OF2的熔、沸点低于Cl2O,原因是
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为
②图乙TiO2-aNb晶体中a=
您最近一年使用:0次
2 . 我国科学家成功合成了一种具有超高能量且室温下稳定的盐(局部结构如图),其中含有两种10电子离子。下列说法错误的是
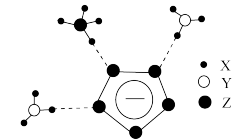

| A.经X射线衍射实验可测得该盐的晶体结构 |
| B.该盐可用于制造炸药 |
| C.两种10电子离子中均含配位键 |
D.图中 离子中Z原子采取 离子中Z原子采取 杂化 杂化 |
您最近一年使用:0次
2022-04-22更新
|
507次组卷
|
4卷引用:湖南省益阳市桃江县第一中学2021-2022学年高三下学期期中考试化学试题
名校
解题方法
3 . 过渡金属配合物的一些特有性质的研究正受到许多研究人员的关注,因为这方面的研究无论是理论上还是工业应用上都有重要意义。
(1)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

此配离子中含有的作用力有____ (填字母)。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)此配合物中碳原子的杂化轨道类型有____ 。
(3)与H2O分子互为等电子体的阴离子为____ 。
(4)下列微粒中键角按由大到小的顺序排列为____ (用序号填写)。
①CO2②SiF4③SCl2④CO ⑤H3O+
⑤H3O+
(5)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是____ 。根据对角线规则,B的一些化学性质与元素____ 的相似。
②氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2,B3O
+9H2,B3O 的结构如图所示;在该反应中,B原子的杂化轨道类型由
的结构如图所示;在该反应中,B原子的杂化轨道类型由____ 变为____ 。

(1)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:

此配离子中含有的作用力有
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)此配合物中碳原子的杂化轨道类型有
(3)与H2O分子互为等电子体的阴离子为
(4)下列微粒中键角按由大到小的顺序排列为
①CO2②SiF4③SCl2④CO
 ⑤H3O+
⑤H3O+(5)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是
②氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH
 +B3O
+B3O +9H2,B3O
+9H2,B3O 的结构如图所示;在该反应中,B原子的杂化轨道类型由
的结构如图所示;在该反应中,B原子的杂化轨道类型由
您最近一年使用:0次
2022-04-21更新
|
225次组卷
|
2卷引用:湖南省株洲市第二中学2021届高三下学期第三次模拟考试化学试卷
名校
解题方法
4 . 碳、硅及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Si原子价层电子的运动状态有_______ 种。
(2)C、O、Si电负性由小到大的顺序为_______ ;CS2分子的空间构型为_______ ;CS2的熔点_______ (填“高于”或“低于”)CO2。
(3)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
SiO2晶体中Si原子采取的构型是_______ (填“甲”或“乙”),其杂化方式为_______ ,从能量角度解释Si原子采取该构型的原因是_______ 。
(4)碳化硅(SiC)是人工合成的无机非会属材料,其晶体结构类似于金刚石,结构如图所示:

①在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是_______ (填字母)。
a. b.
b.  c.
c.  d.
d. 
②SiC晶体中硅原子与最近碳原子间距离为d cm,则硅原子与最近的硅原子间距离为_______ ,一个硅原子周围与其最近的硅原子的数目为_______ 。
③如果SiC晶胞边长为a nm,则SiC晶体的密度为_______ g·cm-3。(用含有a的式子表示)
(1)基态Si原子价层电子的运动状态有
(2)C、O、Si电负性由小到大的顺序为
(3)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
| 化学键 | 键能/(kJ·mol-1) | 化学键 | 键能/(kJ·mol-1) |
| C-C | 331 | C-O | 343 |
| Si-Si | 197 | Si-O | 466 |
| C=C | 620 | CO | 805 |
| Si-Si | 272 | Si=O | 640 |
(4)碳化硅(SiC)是人工合成的无机非会属材料,其晶体结构类似于金刚石,结构如图所示:

①在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是
a.
 b.
b.  c.
c.  d.
d. 
②SiC晶体中硅原子与最近碳原子间距离为d cm,则硅原子与最近的硅原子间距离为
③如果SiC晶胞边长为a nm,则SiC晶体的密度为
您最近一年使用:0次
2022-04-11更新
|
202次组卷
|
2卷引用:湖南省岳阳市岳阳县2021-2022学年高三下学期适应性考试化学试题
名校
解题方法
5 . 钴及其化合物有重要的用途,研究其结构有重要意义。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是 。
。____ 在元素周期表中,该元素属于____ (填“d”或“ds”)区。
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈____ 形,是_____ (填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个_____ 和3个____ 。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,____ (补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。
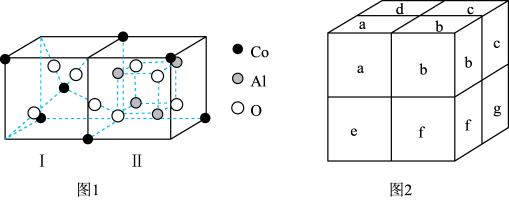
①图2中Ⅱ型小立方体分别是b、____ (填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=____ 。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是
 。
。(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=
您最近一年使用:0次
2022-04-09更新
|
720次组卷
|
5卷引用:湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题
湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市东城区2022届高三一模化学试题(已下线)【奋进985】08-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(广东专用)(已下线)化学-2022年高考押题预测卷03(北京卷)
名校
解题方法
6 . 一种对中枢神经有抑制作用的药物结构如图。其中W、X、Y、Z原子序数依次增大,X、Y、Z位于第二周期,Y的气态氢化物的水溶性显碱性。
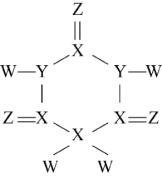
下列判断不正确的是

下列判断不正确的是
| A.第一电离能:X<Z<Y |
| B.XZ2晶体属于共价晶体 |
| C.W与Z可按原子个数比2:1和1:1形成两种化合物 |
| D.该药物在碱性溶液中加热,可水解产生Y的气态氢化物 |
您最近一年使用:0次
2022-04-09更新
|
1645次组卷
|
12卷引用:湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题
湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题北京市东城区2022届高三一模化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)化学-2022年高考考前押题密卷(江苏卷)湖北省鄂东南三校2022届高三下学期5月联考化学试题北京市第一七一中学2022届高三下学期三模化学试题北京首都师范大学附属中学2023届高三上学期10月份月考化学试题北京市第二中学2022-2023学年高三上学期12月考化学试题天津市新华中学2022-2023学年高三第一次模拟考试化学试题河南省禹州市高级中学菁华校区2023-2024学年高三上学期期末考试理综试题-高中化学北京市中关村中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
7 . 已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的基态原子的电子排布式:____ ,Y元素原子最外层电子的轨道表示式:____ 。
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为____ (填“共价键”或“离子键”)。
(3)该化合物的空间结构为____ 形,中心原子的轨道杂化类型为____ ,分子为____ (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____ 。
(5)该化合物的沸点与SiCl4比较:____ (填化学式)的高,原因是____ 。
(1)X元素的基态原子的电子排布式:
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物在常温下为液体,该液体微粒间的作用力是
(5)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
名校
8 . 碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。请根据以下信息,回答下列问题。
(1)下图为金刚石的晶胞:

①沿晶胞对角面取得截图(如图c方式截图),所得截图如图d所示,请在图d中白圈处找出未画出的碳原子,请在图中白圈处找出未画出的碳原子,并在相应位置上按图示碳原子涂黑_______ 。
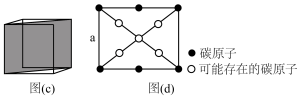
②已知在金刚石晶体中,每个碳原子周围的任意两根碳碳键被2个六元碳环所共有,请计算:金刚石晶体中每个碳原子被_______ 个六元碳环所共有,每个C—C被_______ 个六元碳环所共用。
③若再将任何两个成键的碳原子连线的中心处插入一个氧原子,就构成了某种特殊“碳氧化物”的晶胞。下列说法正确的是_______ (填标号)。
a.该“碳氧化物”晶体中每个碳原子周围的氧原子数是2
b.一个晶胞中含有8个“碳氧化物”分子
c.该“碳氧化物”的化学式为CO2
d.这种晶体是共价晶体
(2)①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是_______ 。

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp2杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
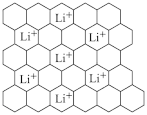
②石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物,某石墨嵌入化合物的平面结构如图所示,则x=_______ ;若每个六元环都对应一个Li+,则化学式为_______ 。
(1)下图为金刚石的晶胞:

①沿晶胞对角面取得截图(如图c方式截图),所得截图如图d所示,请在图d中白圈处找出未画出的碳原子,请在图中白圈处找出未画出的碳原子,并在相应位置上按图示碳原子涂黑

②已知在金刚石晶体中,每个碳原子周围的任意两根碳碳键被2个六元碳环所共有,请计算:金刚石晶体中每个碳原子被
③若再将任何两个成键的碳原子连线的中心处插入一个氧原子,就构成了某种特殊“碳氧化物”的晶胞。下列说法正确的是
a.该“碳氧化物”晶体中每个碳原子周围的氧原子数是2
b.一个晶胞中含有8个“碳氧化物”分子
c.该“碳氧化物”的化学式为CO2
d.这种晶体是共价晶体
(2)①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp2杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
②石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物,某石墨嵌入化合物的平面结构如图所示,则x=

您最近一年使用:0次
名校
解题方法
9 . 镍铜合金由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,无磁性,是制造行波管和其他电子管较好的结构材料。还可作为航空发动机的结构材料。
(1)基态铜原子的价层电子的轨道表示式为_______ ,Cu与Fe的第二电离能分别为:ICu=1959kJ·mol-1,IFe=1562kJ·mol-1,结合价层电子排布式解释Fe的第二电离能较小的原因是_______ 。
(2)向4mL0.1mol/LCuSO4溶液中滴加氨水可形成[Cu(NH3)4]SO4溶液,再向溶液中加入8mL95%的乙醇,并用玻璃棒摩擦器壁析出深蓝色晶体Cu(NH3)4]SO4·H2O。
①NH3中心原子的轨道杂化类型为_______ 。NH3的沸点高于CH4的沸点,其原因是_______ 。
②简单说明加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因_______ 。
(3)某镍铜合金的立方晶胞结构如图所示。
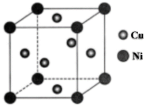
①在该晶胞中镍原子与铜原子的数量比为_______ 。
②若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______ g·cm-3(NA表示阿伏加德罗常数,列出计算式)。
(1)基态铜原子的价层电子的轨道表示式为
(2)向4mL0.1mol/LCuSO4溶液中滴加氨水可形成[Cu(NH3)4]SO4溶液,再向溶液中加入8mL95%的乙醇,并用玻璃棒摩擦器壁析出深蓝色晶体Cu(NH3)4]SO4·H2O。
①NH3中心原子的轨道杂化类型为
②简单说明加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因
(3)某镍铜合金的立方晶胞结构如图所示。

①在该晶胞中镍原子与铜原子的数量比为
②若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=
您最近一年使用:0次
2022-04-02更新
|
398次组卷
|
3卷引用:湖南省邵阳市洞口县第一中学2021-2022学年高三下学期四月月考化学试题
名校
解题方法
10 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染,其结构简式如图所示。下列说法正确的是
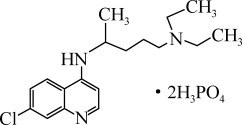
| A.第一电离能:O>N>C | B.该有机物中碳原子采取sp、 杂化 杂化 |
| C.基态氢原子电子云轮廓图为哑铃形 | D. 的空间结构与VSEPR模型相同 的空间结构与VSEPR模型相同 |
您最近一年使用:0次
2022-03-22更新
|
797次组卷
|
5卷引用:湖南省名校联考联合体2021-2022学年高二下学期3月联考化学试题
湖南省名校联考联合体2021-2022学年高二下学期3月联考化学试题辽宁省沈阳市东北育才学校科学高中2021-2022学年高二下学期线上4月测试化学试题浙江省杭州第二中学2023届高三下学期3月月考化学试题(已下线)化学-2023年高考押题预测卷03(浙江卷)(含考试版、全解全析、参考答案、答题卡)吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题



