解题方法
1 . 回答下列问题:
(1)我国自主研发的DF—31A洲际战略导弹是我国大国地位、国防实力的显著标志,其材料中包含了Fe、Cr、Ni、C等多种元素。
①基态镍原子的价电子排布式为__ 。
②Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K___ (填“>”或“<”)Cr;
③SCN-常用于检验Fe3+,其对应酸有硫氰酸(H—S—C≡N)和异硫氰酸(H—N=C=S)两种。硫氰酸分子中σ键与π键的数目比为___ ,异硫氰酸沸点较高的原因是__ 。
(2)大连理工大学彭孝军院士课题组报道了基于硼氟荧类荧光染料(BODIPY)的铜荧光探针的设计与应用,利用Cu2+诱导胺的氧化脱氢反应形成的Cu+配合物,进行Hela细胞中的Cu2+荧光成像和检测。其反应如图所示:
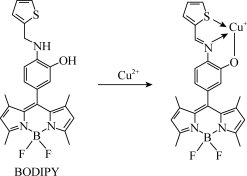
在水溶液里,Cu2+比Cu+稳定,是由于水分子配体的作用。在气态时,Cu2+比Cu+活泼的原因是____ ;BODIPY荧光探针分子中,1molBODIPY分子中含有__ mol配位键。
(3)六方石墨和三方石墨都是由石墨层形分子平行堆积而形成的晶体。已知六方石墨晶体由层状石墨“分子”按ABAB…方式堆积而成,如图甲所示,一个石墨的六方晶胞如图乙所示。而三方石墨层形分子堆积的次序为ABCABC
 ,一个三方石墨晶胞如图丙所示。
,一个三方石墨晶胞如图丙所示。
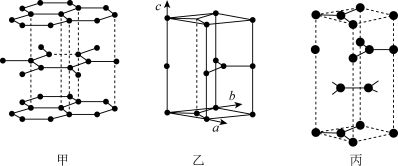
画出六方石墨晶胞沿c轴的投影:__ (用“·”标出碳原子位置即可),已知一个三方石墨晶胞的体积为Vpm3,则该晶胞的密度为__ g/cm3。(用含NA和V的代数式表示)
(1)我国自主研发的DF—31A洲际战略导弹是我国大国地位、国防实力的显著标志,其材料中包含了Fe、Cr、Ni、C等多种元素。
①基态镍原子的价电子排布式为
②Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K
③SCN-常用于检验Fe3+,其对应酸有硫氰酸(H—S—C≡N)和异硫氰酸(H—N=C=S)两种。硫氰酸分子中σ键与π键的数目比为
(2)大连理工大学彭孝军院士课题组报道了基于硼氟荧类荧光染料(BODIPY)的铜荧光探针的设计与应用,利用Cu2+诱导胺的氧化脱氢反应形成的Cu+配合物,进行Hela细胞中的Cu2+荧光成像和检测。其反应如图所示:

在水溶液里,Cu2+比Cu+稳定,是由于水分子配体的作用。在气态时,Cu2+比Cu+活泼的原因是
(3)六方石墨和三方石墨都是由石墨层形分子平行堆积而形成的晶体。已知六方石墨晶体由层状石墨“分子”按ABAB…方式堆积而成,如图甲所示,一个石墨的六方晶胞如图乙所示。而三方石墨层形分子堆积的次序为ABCABC

 ,一个三方石墨晶胞如图丙所示。
,一个三方石墨晶胞如图丙所示。
画出六方石墨晶胞沿c轴的投影:
您最近一年使用:0次
名校
解题方法
2 . 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(图1)。 为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
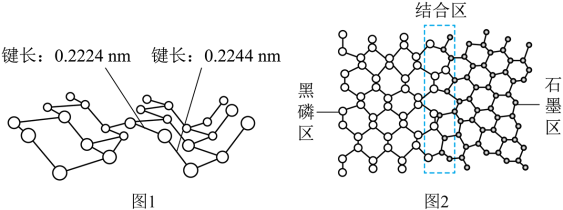
回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是_________________ (用元素符号作答)。
(2)基态磷原子价电子排布式为________________ 。
(3)图2黑磷区中P原子的杂化方式为_________________ ,石墨区中C原子的杂化方式为____________ 。
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为________________ 。
(5)根据图1和图2的信息,下列说法正确的有________ (填字母)。
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
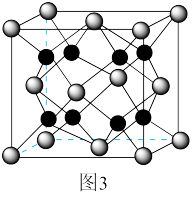
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为___________________ , 晶体的密度为__________ g·cm-3(列出计算式)。

回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是
(2)基态磷原子价电子排布式为
(3)图2黑磷区中P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为
(5)根据图1和图2的信息,下列说法正确的有
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

您最近一年使用:0次
2021-05-28更新
|
735次组卷
|
9卷引用:湖南省长沙市第一中学2021-2022学年高三上学期月考化学试题
湖南省长沙市第一中学2021-2022学年高三上学期月考化学试题湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题广东省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题(已下线)3.3.2 过渡晶体和混合型晶体-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)广东省深圳外国语学校2021-2022学年下学期高三第二次检测考试化学试题(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练广东省惠州市惠州中学2022-2023学年高二下学期化学考试题
3 . 二氧化碳化学资源化利用已经显示出越来越重要的科技与经济价值,如用铜锌氧化物催化二氧化碳加氢生成 ,合成碳酸乙烯酯(EC)等。回答下列问题:
,合成碳酸乙烯酯(EC)等。回答下列问题:
(1)基态铜原子价电子排布式为___________ ;第一电离能 的原因是
的原因是___________ 。
(2) 的空间构型为
的空间构型为___________ 。
(3)EC的结构简式为 ,其碳原子杂化方式为
,其碳原子杂化方式为___________ ,每个分子中含___________ 个 键。
键。
(4) 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是___________ 。
(5)高温时,太阳能反应器中的 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:

①Ce的配位数为___________ 。
②若高温下该晶胞中1个氧原子变为空位,___________ 个面心上的铈由+4价变为+3价(不考虑顶点)。
③已知 的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=___________ pm。
 ,合成碳酸乙烯酯(EC)等。回答下列问题:
,合成碳酸乙烯酯(EC)等。回答下列问题:(1)基态铜原子价电子排布式为
 的原因是
的原因是(2)
 的空间构型为
的空间构型为(3)EC的结构简式为
 ,其碳原子杂化方式为
,其碳原子杂化方式为 键。
键。(4)
 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是(5)高温时,太阳能反应器中的
 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
①Ce的配位数为
②若高温下该晶胞中1个氧原子变为空位,
③已知
 的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
您最近一年使用:0次
2021-05-20更新
|
360次组卷
|
3卷引用:湖南省永州市省重点中学2021届高三5月联考化学试题
名校
解题方法
4 . 金属Ni可以与Mg、C形成一种化合物M,M是一种新型超导体,它的临界温度为8K。回答下列问题:
(1)在基态Mg原子中,核外存在___________ 对自旋相反的电子。
(2)碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知CO 的空间构型为
的空间构型为 ___________ ,其中碳原子的杂化轨道类型为___________ 。NaHCO3的溶解度比Na2CO3的小,其原因是HCO 在水溶液中易形成多聚离子,请解释HCO
在水溶液中易形成多聚离子,请解释HCO 形成多聚离子的原因是
形成多聚离子的原因是___________ 。
(3)Ni的基态原子的价层电子排布式为___________ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________ 。向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为___________ 。
(4)已知M的晶胞(α = β = γ = 90°)结构如下图所示,则M的化学式为___________ 。其晶胞参数为:a = b = c = d pm,该晶体的密度为___________ g·cm-3.(列出计算式)

(1)在基态Mg原子中,核外存在
(2)碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知CO
 的空间构型为
的空间构型为  在水溶液中易形成多聚离子,请解释HCO
在水溶液中易形成多聚离子,请解释HCO 形成多聚离子的原因是
形成多聚离子的原因是(3)Ni的基态原子的价层电子排布式为
(4)已知M的晶胞(α = β = γ = 90°)结构如下图所示,则M的化学式为

您最近一年使用:0次
2021-05-18更新
|
296次组卷
|
4卷引用:湖南省衡阳市衡东县第一中学2022届高三下学期第二次月考化学试题
名校
解题方法
5 . 乙炔是有机合成工业的一种重要原料。工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔。
(1)焦炭、金刚石和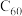 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为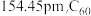 中碳碳键的键长为
中碳碳键的键长为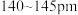 ,二者比较熔点高的是
,二者比较熔点高的是___________ ,理由是___________ 。
(2)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是___________ ,该分子中 键与
键与 键个数比为
键个数比为___________ 。
(3)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为___________ 。 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:___________ 。
(4)CaC2中 与
与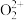 互为等电子体,
互为等电子体,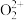 的电子式为
的电子式为___________ 。
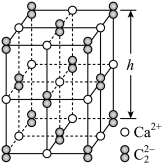
(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有___________ 个。已知CaC2晶体密度为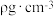 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=___________ cm。
(1)焦炭、金刚石和
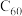 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为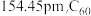 中碳碳键的键长为
中碳碳键的键长为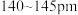 ,二者比较熔点高的是
,二者比较熔点高的是(2)乙炔与氢氰酸反应可得丙烯腈
 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是 键与
键与 键个数比为
键个数比为(3)将乙炔通入
 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(4)CaC2中
 与
与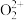 互为等电子体,
互为等电子体,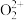 的电子式为
的电子式为(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形
 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有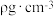 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
您最近一年使用:0次
2021-05-04更新
|
569次组卷
|
5卷引用:湖南省郴州市临武县第一中学2022届高三下学期第二次模拟考试化学试题
湖南省郴州市临武县第一中学2022届高三下学期第二次模拟考试化学试题山东省菏泽市2021届4月高三联考(二模)化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)2023年高考浙江卷化学真题(6月)变式题(结构与性质)
名校
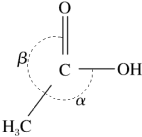
6 . LiAlH4是一种强还原剂,能将乙酸(如图所示)直接还原成乙醇,即:CH3COOH CH3CH2OH,下列有关说法
CH3CH2OH,下列有关说法不正确 的是
 CH3CH2OH,下列有关说法
CH3CH2OH,下列有关说法
| A.第三周期元素中简单离子半径最小的是Al3+ |
| B.AlH4-的空间构型是正四面体形 |
| C.CH3COOH分子中键角α>β |
| D.上述反应中通过官能团间的转化实现了物质类别的转化 |
您最近一年使用:0次
2021-04-08更新
|
672次组卷
|
10卷引用:湖南省湖南师范大学附属中学2021-2022学年高二上学期期末考试化学试题
湖南省湖南师范大学附属中学2021-2022学年高二上学期期末考试化学试题山东师范大学附属中学2020-2021学年高二4月学分认定考试化学试题山东省德州市实验中学2020-2021学年高二下学期期中考试化学试题福建泉州实验中学、养正中学2020-2021学年高二下学期期中联考化学试题吉林省东北师范大学附属中学2021-2022学年高二下学期阶段验收考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题吉林省吉化第一高级中学校2021-2022学年高二上学期期末考试化学试题黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题福建省南平市高级中学2022-2023学年高二下学期期中考试化学试题
解题方法
7 . 在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了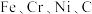 等多种元素。请回答:
等多种元素。请回答:
(1)基态铁原子的价电子排布式为____ , 的熔点为
的熔点为 ,沸点为
,沸点为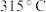 ,
, 的晶体类型是
的晶体类型是__ 。
(2)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与 紧邻且等距离的
紧邻且等距离的 数目为
数目为____ ; 与
与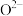 最短核间距为
最短核间距为___  。
。

(3)硫酸镍溶于氨水形成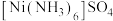 蓝色溶液。
蓝色溶液。
①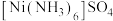 中阴离子的立体构型是
中阴离子的立体构型是___ ;
②在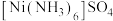 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_ ,提供孤电子对的成键原子是_ 。
(4)无水 和氨分子作用能形成某种配合物,该配合物的组成相当于
和氨分子作用能形成某种配合物,该配合物的组成相当于 。已知:若加入
。已知:若加入 溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入
溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入 溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式
溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式___ , 该配合物中含有σ键的数目为
该配合物中含有σ键的数目为____ 。
 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了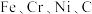 等多种元素。请回答:
等多种元素。请回答:(1)基态铁原子的价电子排布式为
 的熔点为
的熔点为 ,沸点为
,沸点为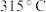 ,
, 的晶体类型是
的晶体类型是(2)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为
 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与 紧邻且等距离的
紧邻且等距离的 数目为
数目为 与
与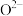 最短核间距为
最短核间距为 。
。
(3)硫酸镍溶于氨水形成
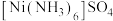 蓝色溶液。
蓝色溶液。①
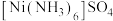 中阴离子的立体构型是
中阴离子的立体构型是②在
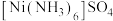 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为(4)无水
 和氨分子作用能形成某种配合物,该配合物的组成相当于
和氨分子作用能形成某种配合物,该配合物的组成相当于 。已知:若加入
。已知:若加入 溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入
溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入 溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式
溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式 该配合物中含有σ键的数目为
该配合物中含有σ键的数目为
您最近一年使用:0次
2021-03-28更新
|
375次组卷
|
3卷引用:湖南省郴州市2021届高三3月第三次教学质量监测化学试题
湖南省郴州市2021届高三3月第三次教学质量监测化学试题湖南省邵阳市2021届高三第一次模拟测试化学试题(已下线)2021年高考化学押题预测卷(山东卷)(01)(含考试版、答题卡、参考答案、全解全析)
名校
解题方法
8 . Fe、Co、Ni 是几种重要的金属元素。请回答下列问题:
(1)基态 Ni 原子的价电子排布式为_______ 。
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4 是_______ 分子(填“极性”或“非极性”)。
(3)实验室常用 KSCN 溶液或苯酚(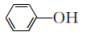 )检验
)检验 。
。
①第一电离能:N_______ O(填“>”或“<”)
②苯酚中碳原子杂化类型为_______ 。
(4)配位化合物 中心原子Co的配位数为
中心原子Co的配位数为_______ ,配位原子为_______ 。
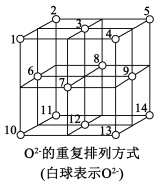
(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______ 。
(6)已知 Ni可以形成多种氧化物,其中一种 NixO 晶体的晶胞结构为 NaCl 型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为_______ g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。
(1)基态 Ni 原子的价电子排布式为
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4 是
(3)实验室常用 KSCN 溶液或苯酚(
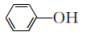 )检验
)检验 。
。①第一电离能:N
②苯酚中碳原子杂化类型为
(4)配位化合物
 中心原子Co的配位数为
中心原子Co的配位数为(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的
 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
(6)已知 Ni可以形成多种氧化物,其中一种 NixO 晶体的晶胞结构为 NaCl 型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为
您最近一年使用:0次
2021-03-19更新
|
1166次组卷
|
9卷引用:湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题
湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题山东省德州市2021届高三下学期高考第一次模拟考试化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅱ卷)(01)(含考试版、答题卡、参考答案、全解全析)山东省日照市2021届高三第二次模拟考试化学试题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)新疆维吾尔自治区乌鲁木齐市第一中学2022届高三第一次适应性检测(一模)理综化学试题云南省大理州实验中学2022-2023学年高三上学期化学开学考试
解题方法
9 . 重金属的化合物易对环境造成污染及引起人体伤害,元素砷本身无毒,其存在于自然界各种金属矿中,它主要以各种砷化物的形式经呼吸道、消化道、皮肤进入体内引起人体中毒。回答下列问题:
(1)基态砷原子核外电子排布中有___________ 个未成对电子;第一电离能数据I(As)大于I(Se),可能的原因是___________ 。
(2)砷烷(AsH3)的空间构型为___________ ;砷烷中心原子杂化方式为___________ ;AsH3的熔沸点高于PH3,其主要原因是___________ 。Na3AsO4可作杀虫剂,其组成元素的电负性大小顺序是___________ 。
(3)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其立方晶胞结构如图所示,晶胞边长a=666.67pm,则其密度为___________ g/cm3(边长a可用2000/3近似计算,设NA=6.0×1023 mol-1)

(4)已知砷黄铁矿(FeAsS)煅烧可生成砒霜(As2O3)和红棕色固体,则该反应的化学方程式为___________ 。
(1)基态砷原子核外电子排布中有
(2)砷烷(AsH3)的空间构型为
(3)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其立方晶胞结构如图所示,晶胞边长a=666.67pm,则其密度为

(4)已知砷黄铁矿(FeAsS)煅烧可生成砒霜(As2O3)和红棕色固体,则该反应的化学方程式为
您最近一年使用:0次
名校
10 . 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。下列说法不正确的
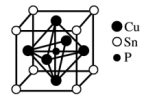

| A.磷锡青铜的化学式为Cu3SnP |
| B.该晶胞中与Sn原子等距离且最近的铜原子有12个 |
| C.该晶体的熔点比金刚砂(SiC)的熔点高 |
| D.磷锡青铜具有各向异性的特点 |
您最近一年使用:0次
2021-03-10更新
|
609次组卷
|
5卷引用:湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题



