名校
1 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
214次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等多校2023-2024学年高二下学期入学考试化学试题
名校
2 . 乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等形成稳定环状离子,其中Cu2+与乙二胺形成的化合物稳定性更高。下列说法错误的是
| A.铜的第二电离能小于锌的第二电离能 |
| B.乙二胺中2个N原子均可与Cu2+形成配位键 |
| C.基态铜原子4s电子能量较高,总是在比3s电子离核更远的地方运动 |
| D.基态Mg原子中,电子占据的最高能层具有的原子轨道为9 |
您最近一年使用:0次
2024-04-05更新
|
113次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
3 . 下列对有关事实的解释错误的是
选项事实 | 解释 | |
A |
|
|
B |
|
|
C | 金刚石的熔点高于单晶硅 | 金刚石的C―C比单晶硅的Si―Si键能大 |
D | 某些金属盐灼烧时呈现不同焰色 | 电子从低能级轨道跃迁至高能级轨道后,又从高能级轨道跃迁至低能级轨道,释放出不同波长的光 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-25更新
|
295次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
4 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。___________ 。
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为( )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为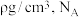 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ 。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

①铁、铝金属间化合物的化学式为
 )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标②则该立方晶胞的密度为
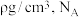 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次
名校
5 . 在国家卫健委2020年2月发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,有一款试用药是老药新用,其分子结构如图所示.已知该药物由短周期元素组成,X、Y为同主族元素,X的原子半径小于Y,X、Y原子的质子数之和减去Y原子的最外层电子数即为Z的原子序数.下列说法错误的是
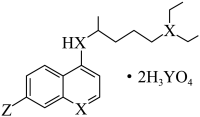

| A.Z的电负性比Y大 |
| B.该药物分子中X原子有两种杂化方式 |
| C.X、Y、Z的常见单质都属于分子晶体 |
| D.Y与Z形成的化合物中,原子的最外层都达到了8电子稳定结构 |
您最近一年使用:0次
名校
6 . 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通信等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为______ ;与硒同周期的p区元素中第一电离能大于硒的元素有______ 种; 的空间结构是
的空间结构是______ 。
(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______ 。硅与氢结合能形成一系列的二元化合物 、
、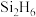 等,与氯、溴结合能形成
等,与氯、溴结合能形成 、
、 ,上述四种物质沸点由高到低的顺序为
,上述四种物质沸点由高到低的顺序为______ ,丁硅烯( )中
)中 键与
键与 键个数之比为
键个数之比为______ 。
(3)GaN、GaP、GaAs都是共价晶体,熔点如下表所示,分析其熔点变化的原因:______ 。
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为
 的空间结构是
的空间结构是(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
 、
、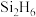 等,与氯、溴结合能形成
等,与氯、溴结合能形成 、
、 ,上述四种物质沸点由高到低的顺序为
,上述四种物质沸点由高到低的顺序为 )中
)中 键与
键与 键个数之比为
键个数之比为(3)GaN、GaP、GaAs都是共价晶体,熔点如下表所示,分析其熔点变化的原因:
| 晶体 | GaN | GaP | GaAs |
| 熔点 | 1700℃ | 1480℃ | 1238℃ |
您最近一年使用:0次
名校
解题方法
7 . 已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的基态原子的电子排布式:____ ,Y元素原子最外层电子的轨道表示式:____ 。
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为____ (填“共价键”或“离子键”)。
(3)该化合物的空间结构为____ 形,中心原子的轨道杂化类型为____ ,分子为____ (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____ 。
(5)该化合物的沸点与SiCl4比较:____ (填化学式)的高,原因是____ 。
(1)X元素的基态原子的电子排布式:
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物在常温下为液体,该液体微粒间的作用力是
(5)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
名校
8 . 我国科学家研究的第五代甲醇生产技术被誉为“液态阳光”,该技术中水经过太阳能光解制得氢气,再利用二氧化碳催化加氢合成甲醇。回答下列问题:
(1)太阳能光解时使用的太阳能电池板的主要成分为单晶硅,硅在周期表中的位置为____ 。
(2)硫化氢分子和水分子结构相似,但冰中水分子周围紧邻的分子数(4个)远小于硫化氢的(12个),原因是____ 。
(3)二氧化碳是重要的碳源,1molCO2分子中存在____ 个π键,碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式:_____ 。基态氧原子有____ 种不同形状的电子云。
(4)磷化硼纳米颗粒可以作为CO2合成甲醇时的非金属电催化剂,磷化硼硬度极大,在数千摄氏度高温时也较稳定,其立方晶胞结构如图所示。回答下列问题:

①晶胞中含有的P原子与B原子的个数比为____ ,晶体中与P原子距离最近且相等的P原子数为____ 。
②已知阿伏加德罗常数的值为NA,磷化硼的晶胞参数为apm,磷化硼晶体的密度ρ=___ g·cm-3。
(1)太阳能光解时使用的太阳能电池板的主要成分为单晶硅,硅在周期表中的位置为
(2)硫化氢分子和水分子结构相似,但冰中水分子周围紧邻的分子数(4个)远小于硫化氢的(12个),原因是
(3)二氧化碳是重要的碳源,1molCO2分子中存在
(4)磷化硼纳米颗粒可以作为CO2合成甲醇时的非金属电催化剂,磷化硼硬度极大,在数千摄氏度高温时也较稳定,其立方晶胞结构如图所示。回答下列问题:

①晶胞中含有的P原子与B原子的个数比为
②已知阿伏加德罗常数的值为NA,磷化硼的晶胞参数为apm,磷化硼晶体的密度ρ=
您最近一年使用:0次
2022-02-22更新
|
183次组卷
|
4卷引用:湖南省百所学校大联考2021-2022学年高二下学期入学考试化学试题
名校
解题方法
9 . 下列叙述正确的个数是
①s—sσ键与s—pσ键的电子云形状相同
②Ge是第IVA族的元素,其基态原子的价层电子排布的轨道表示式为
③Be与Al在周期表中处于对角线位置,可推出:Be(OH)2+2OH-=BeO +2H2O
+2H2O
④非极性分子往往是高度对称的分子,如BF3、PCl5、H2O2、CO2、O3
①s—sσ键与s—pσ键的电子云形状相同
②Ge是第IVA族的元素,其基态原子的价层电子排布的轨道表示式为

③Be与Al在周期表中处于对角线位置,可推出:Be(OH)2+2OH-=BeO
 +2H2O
+2H2O④非极性分子往往是高度对称的分子,如BF3、PCl5、H2O2、CO2、O3
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2022-02-22更新
|
354次组卷
|
3卷引用:湖南省百所学校大联考2021-2022学年高二下学期入学考试化学试题
名校
解题方法
10 . 氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域。已知氮、硅的原子结构示意图如下所示,请推测氮化硅的化学式为( ).


| A.Si3N4 | B.Si4N3 | C.Si3N7 | D.Si7N3 |
您最近一年使用:0次
2020-07-30更新
|
148次组卷
|
3卷引用:湖南省长沙市雅礼洋湖2019-2020学年高一上学期入学分班考试化学试题

 的熔点比干冰高
的熔点比干冰高 相对分子质量大,分子间作用力大
相对分子质量大,分子间作用力大 的酸性比
的酸性比 强
强

