名校
1 . 过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是______(填标号)。
(2) 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。
①该配位化合物中心离子的价层电子排布式为______ ,中心离子的配位数为______ 。
②该配位化合物中含氮离子的中心原子的杂化类型为______ 。
(3)① 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是______ 。
②已知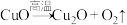 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因______ 。
(4) 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为______ g( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)下列有关说法正确的是______(填标号)。
| A.铜元素焰色试验的光谱为吸收光谱 |
| B.金属键没有方向性和饱和性 |
| C.基态铁原子核外未成对电子有4个 |
| D.锌属于过渡元素,处于元素周期表的d区 |
 是钴元素形成的一种配位化合物。
是钴元素形成的一种配位化合物。①该配位化合物中心离子的价层电子排布式为
②该配位化合物中含氮离子的中心原子的杂化类型为
(3)①
 、
、 的晶体结构均属于
的晶体结构均属于 型(
型( 和
和 的半径分别为69pm和74pm),
的半径分别为69pm和74pm), 的熔点比
的熔点比 高,其原因是
高,其原因是②已知
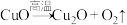 (未配平),试从结构的角度解释这一反应能够发生的原因
(未配平),试从结构的角度解释这一反应能够发生的原因(4)
 与
与 可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为
可形成一种红色晶体,其晶体结构如图所示,则一个晶胞的质量为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。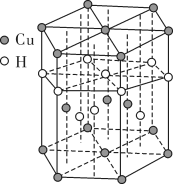
您最近一年使用:0次
名校
解题方法
2 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。___________ 。
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为( )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为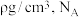 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ 。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为
(3)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

①铁、铝金属间化合物的化学式为
 )、(
)、( ),则晶胞中3号原子的坐标
),则晶胞中3号原子的坐标②则该立方晶胞的密度为
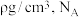 表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次
名校
解题方法
3 . 超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知: 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。

(1) 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是___________ (填标号)。
A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C. 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快
(2) 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。
①基态 的核外电子空间运动状态有
的核外电子空间运动状态有___________ 种。
② 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为___________ ,该晶体密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ pm。

(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠( )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。
①样品中铁元素的质量分数为___________ %。
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为___________ 。
已知:
 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好。
(1)
 具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入
具有强氧化性,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,产生上述现象的原因可能是
,氧化效果大幅度提升,产生上述现象的原因可能是A.烯烃与水互不相溶,高锰酸钾与烯烃不易接触
B.烯烃在冠醚中溶解度好
C.
 随
随 进入冠醚溶液,游离的
进入冠醚溶液,游离的 与烯烃充分接触,反应活性高,反应速率快
与烯烃充分接触,反应活性高,反应速率快(2)
 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。①基态
 的核外电子空间运动状态有
的核外电子空间运动状态有②
 晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为
晶胞结构如图所示,该立方晶胞中Co原子填充的空隙为其配位数为 ,则该晶胞的棱长为
,则该晶胞的棱长为
(3)测定配合物乙二胺四乙酸铁(Ⅲ)钠(
 )样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用
)样品中铁的含量。称取所制取的样品mg,加稀硫酸溶解后配成100mL溶液,取出10mL,加入稍过量的KI溶液,滴入淀粉溶液,用 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为VmL(已知
标准液平均值为VmL(已知 )。
)。①样品中铁元素的质量分数为
②加入稍过量的KI溶液后,此时对应铁元素检验的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应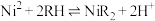 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料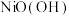 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
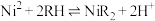 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料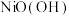 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
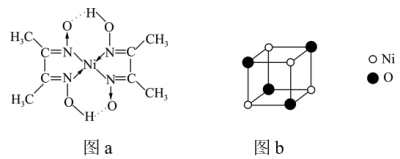
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
2023高三·全国·专题练习
名校
解题方法
5 . M、N、Z、Y、X、T是原子半径依次增大的短周期主族元素,基态N原子核外电子有5种空间运动状态,并有1个单电子,这六种元素形成的一种化合物结构如图所示。下列说法正确的是
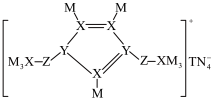

| A.与Y同周期且第一电离能大于Y的元素仅有2种 |
| B.该化合物中只含有离子键和配位键 |
| C.六种元素中,X的最高价含氧酸的酸性最强 |
| D.M与X、Y形成的化合物中,前者的沸点一定低于后者 |
您最近一年使用:0次
名校
解题方法
6 . 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为 ,硼砂的化学式为
,硼砂的化学式为 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:

已知: 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为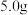 、
、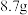 、
、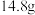 、
、 。
。
(1)B原子的电子排布式为________ 。
(2)硼砂溶于热水后,常用 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是________________________________________________ 。
(3)X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________________ 。
(4) 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是__________ 。
(5)已知硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是_______ 。

已知硼酸在水中电离产生 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是________ (填标号)。
A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.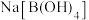 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中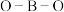 的键角相同
的键角相同
(6)制得的粗硼在一定条件下生成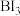 ,
,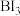 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的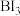 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为________ (提示: )
)
 ,硼砂的化学式为
,硼砂的化学式为 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
已知:
 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为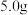 、
、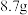 、
、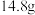 、
、 。
。(1)B原子的电子排布式为
(2)硼砂溶于热水后,常用
 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是(3)X为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(4)
 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是(5)已知硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
已知硼酸在水中电离产生
 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.
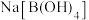 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中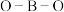 的键角相同
的键角相同(6)制得的粗硼在一定条件下生成
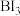 ,
,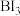 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的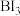 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为 )
)
您最近一年使用:0次
名校
7 . 物质的组成与结构决定了物质的性质与变化。下列说法正确的是
| A.MgO的熔点高于NaCl的熔点 |
| B.金刚石与碳化硅晶体结构相似,金刚石的硬度小于碳化硅 |
| C.CH3CH2CH2COOH的酸性比CH3COOH的酸性强 |
| D.HF晶体沸点高于HCl,是因为HCl共价键键能小于HF |
您最近一年使用:0次
2023-03-18更新
|
682次组卷
|
5卷引用:湖南省长沙市周南中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
8 . 短周期元素X、Y、Z、W中,X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M电子层的p能级中有3个未成对电子。
(1)Z原子的电子排布式为_______ ,若X为非金属元素,则按原子轨道的重叠方式,X与Z形成的化合物中的共价键属于_______ 键(填“σ”或“x”)。
(2)当 时,Y在元素周期表的位置为
时,Y在元素周期表的位置为____ ,YZ2属于____ 分子(填“极性”或“非极性”)。
(3)当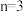 时,YZ2晶体属于
时,YZ2晶体属于_______ 晶体;在Y的含氧酸盐中,Y和Z结合成 四面体,
四面体, 的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为_______ 。

(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(1)Z原子的电子排布式为
(2)当
 时,Y在元素周期表的位置为
时,Y在元素周期表的位置为(3)当
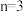 时,YZ2晶体属于
时,YZ2晶体属于 四面体,
四面体, 的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
名校
解题方法
9 . 一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为apm、apm、bpm,1号原子的坐标为( ,
, ,
, ),下列说法错误的是
),下列说法错误的是

 ,
, ,
, ),下列说法错误的是
),下列说法错误的是
A.2号原子的坐标为( , , , ,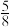 ) ) |
| B.距离硫原子最近的硫原子数目为4 |
| C.硫原子的配位数为4 |
D.该晶体的密度为 g/cm3 g/cm3 |
您最近一年使用:0次
2023-02-02更新
|
1415次组卷
|
5卷引用:湖南师范大学附属中学2023届高三下学期月考(七)化学试题
湖南师范大学附属中学2023届高三下学期月考(七)化学试题广东省江门市部分名校2023届高三高考仿真模拟测试化学试题山西省忻州市2023届高三一模考试理综化学试题(已下线)专题卷20 《物质结构与性质》选择题分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河南省信阳高级中学2023-2024学年高三上学期2月月考理综试题-高中化学
名校
解题方法
10 . 三元锂离子电池是新能源电动车广泛采用的一种电池技术,其中钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图:_______ 。
(2)钴离子极易形成配合物,制备配合物X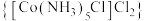 的实验过程如下:
的实验过程如下:
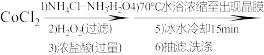
 晶体
晶体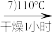 产品
产品
已知:a.配合物X能溶于水,且溶解度随温度升高而增大。
B.Co(OH)2是不溶于水的沉淀
C.H2O2参与反应时,明显放热。当温度高于40℃时,H2O2开始分解。
①“1)NH4Cl-NH3‧H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是_______ 。
②加H2O2时应选择_______ (填标号)。
A.冷水浴 B.温水浴(≈60℃) C.沸水浴 D.酒精灯直接加热
③本实验条件下,下列物质均可将Co(Ⅱ)氧化为Co(Ⅲ)。其中可替代“2) H2O2”的是_______ (填标号)。
A.O2 B.KMnO4溶液 C.Cl2 D.HNO3
④Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如: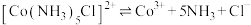 。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量X加入过量浓NaOH溶液,煮沸,将生成的NH3通入20 mL 0.5 mol/L的稀硫酸(过量)中,再用0.200 0 mol/L NaOH标准溶液滴定剩余H2SO4。若滴定过程平均消耗NaOH标准溶液20.00 mL,则所取样品中含有NH3的物质的量n(NH3)=
。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量X加入过量浓NaOH溶液,煮沸,将生成的NH3通入20 mL 0.5 mol/L的稀硫酸(过量)中,再用0.200 0 mol/L NaOH标准溶液滴定剩余H2SO4。若滴定过程平均消耗NaOH标准溶液20.00 mL,则所取样品中含有NH3的物质的量n(NH3)= _______ 。
(3)钴的一种化合物晶胞结构如下图所示:

已知该晶体的密度为 ,则晶胞中Ti与O的最近距离是
,则晶胞中Ti与O的最近距离是____ nm(用含ρ、 的代数式表示)。
的代数式表示)。
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图:
(2)钴离子极易形成配合物,制备配合物X
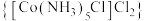 的实验过程如下:
的实验过程如下: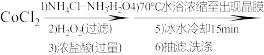
 晶体
晶体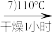 产品
产品已知:a.配合物X能溶于水,且溶解度随温度升高而增大。
B.Co(OH)2是不溶于水的沉淀
C.H2O2参与反应时,明显放热。当温度高于40℃时,H2O2开始分解。
①“1)NH4Cl-NH3‧H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是
②加H2O2时应选择
A.冷水浴 B.温水浴(≈60℃) C.沸水浴 D.酒精灯直接加热
③本实验条件下,下列物质均可将Co(Ⅱ)氧化为Co(Ⅲ)。其中可替代“2) H2O2”的是
A.O2 B.KMnO4溶液 C.Cl2 D.HNO3
④Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:
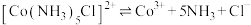 。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量X加入过量浓NaOH溶液,煮沸,将生成的NH3通入20 mL 0.5 mol/L的稀硫酸(过量)中,再用0.200 0 mol/L NaOH标准溶液滴定剩余H2SO4。若滴定过程平均消耗NaOH标准溶液20.00 mL,则所取样品中含有NH3的物质的量n(NH3)=
。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量X加入过量浓NaOH溶液,煮沸,将生成的NH3通入20 mL 0.5 mol/L的稀硫酸(过量)中,再用0.200 0 mol/L NaOH标准溶液滴定剩余H2SO4。若滴定过程平均消耗NaOH标准溶液20.00 mL,则所取样品中含有NH3的物质的量n(NH3)= (3)钴的一种化合物晶胞结构如下图所示:

已知该晶体的密度为
 ,则晶胞中Ti与O的最近距离是
,则晶胞中Ti与O的最近距离是 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



