解题方法
1 . C、Si均为第ⅣA族元素,回答下列问题。
(1)若将基态硅原子最高能级的电子排布图表示为 ,则它违背了
,则它违背了___________ 这一电子排布规律。
(2)以SiO2为基本原料制备粗硅的原理为 ,则C、O、Si第一电离能由大到小的顺序为
,则C、O、Si第一电离能由大到小的顺序为___________ 。
(3)CO2和SiO2两种物质中,C、Si原子的杂化类型分别为___________ ;CO2的熔点远低于SiO2的原因是___________ 。
(4) 的键角为
的键角为___________ ;写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(5)硅的含氧化合物都以硅氧四面体( )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为___________ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为___________ 。

(1)若将基态硅原子最高能级的电子排布图表示为
 ,则它违背了
,则它违背了(2)以SiO2为基本原料制备粗硅的原理为
 ,则C、O、Si第一电离能由大到小的顺序为
,则C、O、Si第一电离能由大到小的顺序为(3)CO2和SiO2两种物质中,C、Si原子的杂化类型分别为
(4)
 的键角为
的键角为 互为等电子体的分子
互为等电子体的分子(5)硅的含氧化合物都以硅氧四面体(
 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
您最近一年使用:0次
2023-01-10更新
|
252次组卷
|
2卷引用:湖南省怀化市2022-2023学年高三下学期期末考试化学试题
名校
解题方法
2 . 砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
(1)基态As 原子核外电子排布式为_______ ,最高能级电子的电子云形状为 _______ 。
(2)GaAs、GaN 结构相似,晶体类型都为共价晶体,沸点GaAs_______ GaN(填“>”或“<”,下同),第一电离能Ga _______ As。
(3)成语“信口雌黄”中雌黄的分子式为 As2S3,分子结构如图 1,As原子的杂化方式为_______ 。

(4)GaAs 的晶胞结构如图 2,在GaAs晶体中,与As原子最近且等距离的As原子数为_______ 。

(5)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为_______ cm。
(1)基态As 原子核外电子排布式为
(2)GaAs、GaN 结构相似,晶体类型都为共价晶体,沸点GaAs
(3)成语“信口雌黄”中雌黄的分子式为 As2S3,分子结构如图 1,As原子的杂化方式为

(4)GaAs 的晶胞结构如图 2,在GaAs晶体中,与As原子最近且等距离的As原子数为

(5)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为
您最近一年使用:0次
2022-09-20更新
|
446次组卷
|
2卷引用:湖南省怀化市沅陵县第一中学2022-2023学年高三上学期第一次阶段性考试化学试题
名校
3 . 铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________ (填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________ ;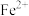 的核外电子排布式为
的核外电子排布式为_____________________ 。
(2)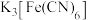 溶液可用于检验
溶液可用于检验_________ (填离子符号);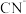 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为_____ ;1mol 含有的π键数目为
含有的π键数目为_______ (用N表示);C、N、O第一电离能由大到小的顺序为_________ (用元素符号表示)。
(3)某M原子的外围电子排布式为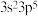 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
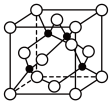
①该晶体的化学式为__________________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________ (填“离子”或“共价”)化合物。
③已知该晶体的密度为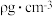 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为____________________ pm(只需写出计算式)。
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
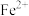 的核外电子排布式为
的核外电子排布式为(2)
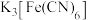 溶液可用于检验
溶液可用于检验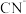 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为 含有的π键数目为
含有的π键数目为(3)某M原子的外围电子排布式为
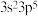 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为
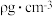 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
2019-04-26更新
|
567次组卷
|
4卷引用:【市级联考】湖南省怀化市2019届高三下学期4月第二次模拟考试理科综合化学试题
4 . (1)写出基态Fe2+的核外电子排布式______________________ ;基态C1原子电子占据最高能级的电子云轮廓图为___________ 形。
(2)SO42-中心原子的轨道杂化类型为___________ ;NO3-的空间构型为___________ 。
(3)萤石晶胞结构如图I所示,则Ca2+的配位数是___________ ,萤石的化学式为 ___________ 。

(4)NiO氧化镍)晶胞结构如图Ⅱ所示,则每个Ni2+周围与其等距离的Ni2+有___________ 个;若Ni2+与最邻近O2-的核间距为a×10-8cm,则NiO晶体的密度为___________ g·cm-3(列出计算式)(已知NiO的摩尔质量为74.7g·mol-1,阿伏伽德罗常数的值为NA)
(2)SO42-中心原子的轨道杂化类型为
(3)萤石晶胞结构如图I所示,则Ca2+的配位数是

(4)NiO氧化镍)晶胞结构如图Ⅱ所示,则每个Ni2+周围与其等距离的Ni2+有
您最近一年使用:0次
5 . 下列说法正确的是
| A.最外层有2个电子的原子都是金属原子 |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
| D.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 |
您最近一年使用:0次
解题方法
6 . 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物。按要求回答下列问题:
(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于___________ (填晶体类型)。
(2)铁在元素周期表中位置是________________ ,亚铁离子具有强还原性,从电子排布的角度解释,其原因是______________________ 。
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为_______________ 。
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于_______ 盐(填“正”、“酸式”)。
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为__________ ;每个N原子周围最近且等距离的N原子数为_______ ;如果阿伏加德罗常数近似取6×1023/mol,立方BN的密度为a g·cm-3,摩尔质量为b g·mol-1,计算晶体中最近的两个N原子间距离是__________ nm(用含a、b代数式表示)。

(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于
(2)铁在元素周期表中位置是
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为

您最近一年使用:0次
解题方法
7 . [化学──选修3 :物质结构与性质]X、Y 、Z、W为元素周期表前四周期的元素。其中X原子核外的L层电子数是K层电子数的两倍, Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题。
(1)W元素属于_______ 区元素,其基态原子的电子排布式为_______ 。
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。其中配体分子的空间构型为_________ ,写出该配离子的结构简式(标明配位键)_____ 。
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为_____ ,1 mol 该分子中σ键的数目为______ ,该物质易溶于水的主要原因是_______ 。
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为_____ 。

(5)元素Y与元素Z形成的晶体结构如图②所示,设晶胞中最近的Y的离子与Z的距离为a pm,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为_________ g/cm3。
(1)W元素属于
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。其中配体分子的空间构型为
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为

(5)元素Y与元素Z形成的晶体结构如图②所示,设晶胞中最近的Y的离子与Z的距离为a pm,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为
您最近一年使用:0次



