名校
1 . 下列对有关事实的解释错误的是
| 选项事实 | 解释 | |
| A | 酸性:CF3COOH>CH3COOH | F电负性更大使羟基极性变强 |
| B | 金刚石的熔点高于单晶硅 | 金刚石的C-C比单晶硅的Si-Si键能大 |
| C | 稳定性:H2O>H2S | H-O键的键能比H-S键的键能大 |
| D | SiO2的熔点比干冰高 | SiO2比CO2相对分子质量大,分子间作用力大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-26更新
|
355次组卷
|
2卷引用:湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . ZnS的晶胞结构如图所示,其晶胞参数为a nm,以晶胞参数建立坐标系,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,1)。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是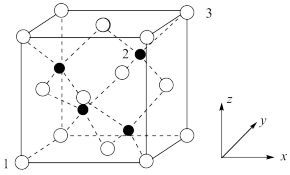
| A.可以用质谱仪测定ZnS晶体结构 |
B.97 g ZnS晶体含有的晶胞数目为 |
C.2号和3号原子之间的距离为 nm nm |
D.2号原子的坐标为(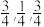 ) ) |
您最近一年使用:0次
2024-01-25更新
|
519次组卷
|
6卷引用:湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题
湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题广东省深圳市高级中学2023-2024学年高二上学期期末考试化学试题广东省广州市铁一中学2023-2024学年高二下学期3月月考化学试题广东省深圳市盐田高级中学2023-2024学年高二下学期4月月考化学试题广东省汕尾市陆河县河田中学2023-2024学年高二下学期4月期中考试化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
名校
解题方法
3 . “钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。
(1)基态V原子核外电子的运动状态有___________ 种。价电子排布图为___________ 。
(2)钒(V)固氮酶种类众多,其中一种结构如图所示:

①配体CH3CN中碳的杂化类型为______ ,所含σ键与π键数目之比为_______ 。
②V位于周围六个原子构成的六面体中心,则该物质中V的杂化方式最可能为____ 。
A.sp2杂化 B.sp3杂化 C.dsp3杂化 D.d2sp3杂化
③该物质中几种非金属简单氢化物中NH3沸点最高,原因为_____ 。键角: ,原因为
,原因为_____ 。
(3) 溶解在
溶解在 溶液中,可得到偏钒酸钠,其阴离子为无限链状结构(如图所示,钒位于体心),则偏钒酸钠的化学式为
溶液中,可得到偏钒酸钠,其阴离子为无限链状结构(如图所示,钒位于体心),则偏钒酸钠的化学式为___________ 。

(4)钒的某种氧化物的立方晶胞结构如图所示,晶胞参数为 。
。

①该氧化物的化学式为___________ 。
②该晶胞的密度为___________  (设NA为阿伏加德罗常数的值)
(设NA为阿伏加德罗常数的值)
(1)基态V原子核外电子的运动状态有
(2)钒(V)固氮酶种类众多,其中一种结构如图所示:

①配体CH3CN中碳的杂化类型为
②V位于周围六个原子构成的六面体中心,则该物质中V的杂化方式最可能为
A.sp2杂化 B.sp3杂化 C.dsp3杂化 D.d2sp3杂化
③该物质中几种非金属简单氢化物中NH3沸点最高,原因为
 ,原因为
,原因为(3)
 溶解在
溶解在 溶液中,可得到偏钒酸钠,其阴离子为无限链状结构(如图所示,钒位于体心),则偏钒酸钠的化学式为
溶液中,可得到偏钒酸钠,其阴离子为无限链状结构(如图所示,钒位于体心),则偏钒酸钠的化学式为
(4)钒的某种氧化物的立方晶胞结构如图所示,晶胞参数为
 。
。
①该氧化物的化学式为
②该晶胞的密度为
 (设NA为阿伏加德罗常数的值)
(设NA为阿伏加德罗常数的值)
您最近一年使用:0次
2022-02-25更新
|
511次组卷
|
3卷引用:湖南省永州市第一中学2022届高三下学期期中考试考试化学试题
湖南省永州市第一中学2022届高三下学期期中考试考试化学试题天津滨海新区八所重点学校2021-2022学年高三下学期毕业班联考化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)
4 . 硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。回答下列问题:
(1)基态硼原子的电子排布式为____ 。
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是____ 。
(3)氨硼烷(H3N·BH3)是目前最具潜力的储氢材料之一。
①氨硼烷能溶于水,其原因是____ 。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是____ 。
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
(4)硼酸(H3BO3)溶液中滴加过量NaOH反应生成[B(OH)4]-,试从分子结构角度解释H3BO3体现一元弱酸性质的原因是____ 。
(5)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为_____ (以n表示硼原子的个数)。如图2表示的是一种五硼酸根离子,其中B原子的杂化方式为____ 。

(6)硼氢化钠是一种常用的还原剂,其晶胞结构如图3所示:

①该晶体中Na+的配位数为____ 。
②已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=____ (用含ρ、NA的代数式表示)。
③若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为____ 。
(1)基态硼原子的电子排布式为
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B—H | B—O | B—B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
①氨硼烷能溶于水,其原因是
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
(4)硼酸(H3BO3)溶液中滴加过量NaOH反应生成[B(OH)4]-,试从分子结构角度解释H3BO3体现一元弱酸性质的原因是
(5)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为

(6)硼氢化钠是一种常用的还原剂,其晶胞结构如图3所示:

①该晶体中Na+的配位数为
②已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=
③若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为
您最近一年使用:0次
5 . 二氧化碳化学资源化利用已经显示出越来越重要的科技与经济价值,如用铜锌氧化物催化二氧化碳加氢生成 ,合成碳酸乙烯酯(EC)等。回答下列问题:
,合成碳酸乙烯酯(EC)等。回答下列问题:
(1)基态铜原子价电子排布式为___________ ;第一电离能 的原因是
的原因是___________ 。
(2) 的空间构型为
的空间构型为___________ 。
(3)EC的结构简式为 ,其碳原子杂化方式为
,其碳原子杂化方式为___________ ,每个分子中含___________ 个 键。
键。
(4) 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是___________ 。
(5)高温时,太阳能反应器中的 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:

①Ce的配位数为___________ 。
②若高温下该晶胞中1个氧原子变为空位,___________ 个面心上的铈由+4价变为+3价(不考虑顶点)。
③已知 的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=___________ pm。
 ,合成碳酸乙烯酯(EC)等。回答下列问题:
,合成碳酸乙烯酯(EC)等。回答下列问题:(1)基态铜原子价电子排布式为
 的原因是
的原因是(2)
 的空间构型为
的空间构型为(3)EC的结构简式为
 ,其碳原子杂化方式为
,其碳原子杂化方式为 键。
键。(4)
 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是(5)高温时,太阳能反应器中的
 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
①Ce的配位数为
②若高温下该晶胞中1个氧原子变为空位,
③已知
 的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
的密度为7.13g/cm3,设NA为阿伏加德罗常数的值,则晶胞边长a=
您最近一年使用:0次
2021-05-20更新
|
360次组卷
|
3卷引用:湖南省永州市省重点中学2021届高三5月联考化学试题
解题方法
6 . 黑磷烯由单层磷原子构成,与石墨烯结构相似,是新发现的一种二维半导体材料,有望代替石墨烯、单晶硅等半导体开创后硅晶时代。回答下列问题:
(1)基态Si原子的价电子轨道表达式为_______ 。
(2)区分无定形硅和单晶硅最可靠的科学方法为_______ ;单晶硅的基本结构单元的立体构型为_______ 。
(3)石墨烯(如图1)、六方氮化硼(如图2)、黑磷烯均可用作电极材料。

①B、P、C、N中,第一电离能最大的是_______ (填元素符号)。
②石墨烯能导电的原因为_______ 。
③六方氮化硼中,B原子的杂化方式为_______ 。
④黑磷烯中P原子的杂化方式为sp3,则黑磷烯_______ (填“是”或“不是”)平面结构;其中P原子杂化轨道的作用为_______ 。
(4)六方氮化硼在一定条件下可转化为立方氮化硼。立方氮化硼与金刚石结构相似,其晶胞结构如图3所示。若立方氮化硼晶体的密度为pg·cm-3,邻近的B、N原子之间的距离为cpm,则阿伏加德罗常数的值NA可表示为_______ (用含c、p的代数式表示)。

(1)基态Si原子的价电子轨道表达式为
(2)区分无定形硅和单晶硅最可靠的科学方法为
(3)石墨烯(如图1)、六方氮化硼(如图2)、黑磷烯均可用作电极材料。

①B、P、C、N中,第一电离能最大的是
②石墨烯能导电的原因为
③六方氮化硼中,B原子的杂化方式为
④黑磷烯中P原子的杂化方式为sp3,则黑磷烯
(4)六方氮化硼在一定条件下可转化为立方氮化硼。立方氮化硼与金刚石结构相似,其晶胞结构如图3所示。若立方氮化硼晶体的密度为pg·cm-3,邻近的B、N原子之间的距离为cpm,则阿伏加德罗常数的值NA可表示为

您最近一年使用:0次
解题方法
7 . 形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__ ,基态Ga原子核外电子占据最高能级的电子云轮廓图为___ 。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___ 。乙炔钠中存在___ (填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____ 。写出和该阴离子互为等电子体的一种分子的结构式___ 。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____ 。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___ 。
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有___ 个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为___ cm。
(1)基态Ga原子的核外电子排布式是[Ar]
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为
您最近一年使用:0次
2020-03-03更新
|
283次组卷
|
3卷引用:湖南省永州市2020届高三“培优”理综化学模拟试卷(三)
名校
解题方法
8 . 下列叙述中正确的个数有( )
①氧原子的电子排布图: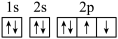 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
①氧原子的电子排布图:
 最外层违背了泡利原理
最外层违背了泡利原理②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2019-11-27更新
|
1601次组卷
|
9卷引用:湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题
湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题(人教版2019)选择性必修2 阶段性综合评估测试卷(一)重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题重庆市南华中学校2021-2022学年高二3月月考化学试题重庆实验外国语学校2021-2022学年高二下学期6月月考化学试题海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题
解题方法
9 . 非金属元素在化学中具有重要地位,请回答下列问题:
(1)氧元素的第一电离能比同周期的相邻元素要小,理由_____________ 。
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X为________ (填元素符号),其基态原子的电子排布式为___________ 。
(3)臭齅排放的臭气主要成分为3-MBT(2-甲基-2-丁烯硫醇),结构简式为 )1mol 3-MBT中含有
)1mol 3-MBT中含有 键数目为
键数目为____ NA(NA为阿伏伽德罗常数的值)。该物质沸点低于(CH3)2C= CHCH2OH,主要原因是______ 。
(4)①人类由反应PtF6+O2=O2[PtF6]第一次制得氧元素显正价的盐,已知PtF6分子为正八面体结构。PFE分子中PtF6的杂化轨道类型是否为sp3?答:_____ (填“是”或“否”),其原因是____________ 。
②PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子;熔体中P-Cl的键长只有198pm和206pm两种,试用电离方程式解释PC熔体能导电的原因_______ ,正四面体形阳离子中键角大于PCl3的键角原因为________________ ,该晶体的晶胞如图所示,立方体的晶胞边长为apm(1pm=10-12m),NA为阿伏伽德罗常数的值,则该晶体的密度为_______ g/cm3。

(1)氧元素的第一电离能比同周期的相邻元素要小,理由
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X为
(3)臭齅排放的臭气主要成分为3-MBT(2-甲基-2-丁烯硫醇),结构简式为
 )1mol 3-MBT中含有
)1mol 3-MBT中含有 键数目为
键数目为(4)①人类由反应PtF6+O2=O2[PtF6]第一次制得氧元素显正价的盐,已知PtF6分子为正八面体结构。PFE分子中PtF6的杂化轨道类型是否为sp3?答:
②PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子;熔体中P-Cl的键长只有198pm和206pm两种,试用电离方程式解释PC熔体能导电的原因

您最近一年使用:0次
名校
10 . 短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中正确的是
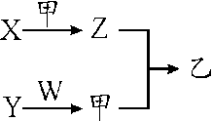
| A.沸点:W>X |
| B.原子半径:D>C>B>A |
| C.C、D两种元素组成的化合物只含有离子键 |
| D.A、B、C三种元素组成的化合物均为共价化合物 |
您最近一年使用:0次
2019-02-04更新
|
535次组卷
|
3卷引用:【市级联考】湖南省永州市2019届高三上学期第二次模拟考试化学试题



