名校
解题方法
1 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题。
(1)砷的价层电子排布式_______ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1=a kJ·mol-1
H2(g)+2O2(g)=H3AsO4(s) ΔH1=a kJ·mol-1
H2(g)+ O2(g)= H2O(l) ΔH2=b kJ·mol-1
O2(g)= H2O(l) ΔH2=b kJ·mol-1
2As(s)+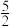 O2(g)=As2O5(s) ΔH3=c kJ·mol-1
O2(g)=As2O5(s) ΔH3=c kJ·mol-1
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=_______ 。
(3)298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1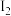 和20 mL NaOH溶液混合,发生反应:.
和20 mL NaOH溶液混合,发生反应:.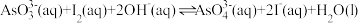 .。溶液中
.。溶液中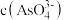 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。_______ (填标号)。
a.溶液的pH不再变化
b.v(I-)=2v( )
)
c.c( )/c(
)/c( )不再变化
)不再变化
d.c(I-)=y mol·L-1
②tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_______ 。
③若平衡时溶液的pH=13,则该反应的平衡常数K为_______ 。
(4)砷化镓是第三代半导体,熔点为1238 ℃,其晶胞结构如图所示。_______ 晶体。
②砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏加德罗常数的值为NA,则砷化镓晶体的密度表达式是_______ g·cm-3。
(1)砷的价层电子排布式
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1=a kJ·mol-1
H2(g)+2O2(g)=H3AsO4(s) ΔH1=a kJ·mol-1H2(g)+
 O2(g)= H2O(l) ΔH2=b kJ·mol-1
O2(g)= H2O(l) ΔH2=b kJ·mol-12As(s)+
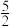 O2(g)=As2O5(s) ΔH3=c kJ·mol-1
O2(g)=As2O5(s) ΔH3=c kJ·mol-1则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=
(3)298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1
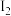 和20 mL NaOH溶液混合,发生反应:.
和20 mL NaOH溶液混合,发生反应:.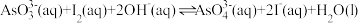 .。溶液中
.。溶液中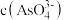 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
a.溶液的pH不再变化
b.v(I-)=2v(
 )
)c.c(
 )/c(
)/c( )不再变化
)不再变化 d.c(I-)=y mol·L-1
②tm时v逆
③若平衡时溶液的pH=13,则该反应的平衡常数K为
(4)砷化镓是第三代半导体,熔点为1238 ℃,其晶胞结构如图所示。
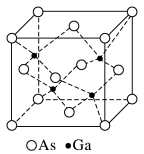
②砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏加德罗常数的值为NA,则砷化镓晶体的密度表达式是
您最近一年使用:0次
名校
解题方法
2 . 前四周期原子序数依次增大的元素 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
(1)实验室常用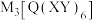 检验
检验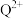 ,反应的离子方程式为
,反应的离子方程式为 。
。
①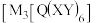 中
中 离子的配位数为
离子的配位数为_______ 。
②形成配位键时, 中提供孤电子对的原子为
中提供孤电子对的原子为_______ (填元素符号)。
③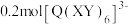 中含
中含_______  键。
键。
(2)金属 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。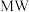 的还原性比
的还原性比 的强,原因为
的强,原因为_______ 。
(3)由 、
、 组成的化合物
组成的化合物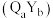 在磁记录材料领域有着广阔的应用前景。某
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为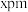 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为_______ (用含 、
、 的代数式表示)
的代数式表示) 。
。
由表中数据可得知: 和
和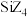 熔点相差较小,
熔点相差较小,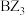 和
和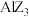 熔点相差较大。请简述
熔点相差较大。请简述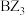 和
和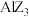 熔点相差较大的原因:
熔点相差较大的原因:_______ 。
(5) 能形成多种配合物,如
能形成多种配合物,如 :
:
① 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为_______ 。
②一定条件下,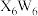 与
与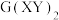 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色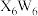 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。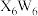 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为_______ ,晶胞中 与
与 间的距离为
间的距离为_______  。
。
 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且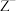 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:(1)实验室常用
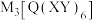 检验
检验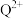 ,反应的离子方程式为
,反应的离子方程式为 。
。①
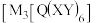 中
中 离子的配位数为
离子的配位数为②形成配位键时,
 中提供孤电子对的原子为
中提供孤电子对的原子为③
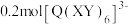 中含
中含 键。
键。(2)金属
 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。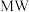 的还原性比
的还原性比 的强,原因为
的强,原因为(3)由
 、
、 组成的化合物
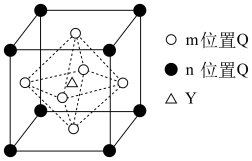
组成的化合物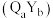 在磁记录材料领域有着广阔的应用前景。某
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为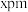 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 、
、 的代数式表示)
的代数式表示) 。
。
| 物质 |  | 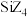 | 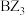 | 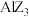 |
熔点/ |  | 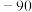 |  | 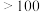 |
 和
和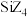 熔点相差较小,
熔点相差较小,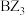 和
和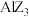 熔点相差较大。请简述
熔点相差较大。请简述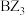 和
和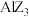 熔点相差较大的原因:
熔点相差较大的原因:(5)
 能形成多种配合物,如
能形成多种配合物,如 :
:①
 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为②一定条件下,
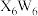 与
与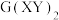 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色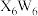 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。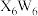 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为 与
与 间的距离为
间的距离为 。
。
您最近一年使用:0次
名校
解题方法
3 . 铁及其化合物在生产生活中应用非常广泛。回答下列问题:
(1)根据价电子排布规律,铁元素位于元素周期表的_______ 区,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.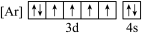 b.
b.
c.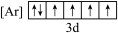 d.
d.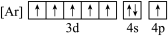
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝),[Fe(CN)6]4-中σ键数目为_______ ,Fe2+的杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.d2sp3 d.dsp3
已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:_______ 。
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为Fe2++3phen═[Fe(phen)3]2+。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是_______ 。
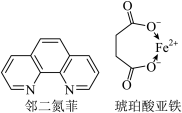
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在: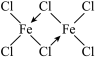 ;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图_______ 。
(1)根据价电子排布规律,铁元素位于元素周期表的
a.
 b.
b.
c.
 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝),[Fe(CN)6]4-中σ键数目为
a.sp2 b.sp3 c.d2sp3 d.dsp3
已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为Fe2++3phen═[Fe(phen)3]2+。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是

a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在:
 ;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
您最近一年使用:0次
名校
解题方法
4 . 碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是___________(填字母序号)。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是___________。

(3)邻硝基苯酚的熔点___________ 对硝基苯酚(填“>”、“=”或“<”=)。
(4)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是___________。
(5)已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。请写出下面这个方程式右端的两种离子的表达式:
 ⇌
⇌___________ 。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是___________(填字母序号)。
| A.完全由非金属元素形成的物质一定是分子晶体或原子晶体 |
| B.分子晶体中分子之间一定存在范德华力 |
| C.SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力 |
| D.金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应 |
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是___________。

| A.C4属于一种新型的化合物 | B.C4与P4(白磷)的晶体都属于分子晶体 |
| C.C4气体分子内含有极性共价键 | D.C4与C60互为同素异形 |
(3)邻硝基苯酚的熔点
(4)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是___________。
| A.CO2 | B.CF4 | C.NF3 | D.OF2 |
(5)已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。请写出下面这个方程式右端的两种离子的表达式:
 ⇌
⇌
您最近一年使用:0次
名校
解题方法
5 . (NH4)2Fe(SO4)26H2O可用于印染、畜等领域。
(1)基态Fe2+中含___________ 个未成对电子数。
(2)(NH4)2Fe(SO4)26H2O中电负性最大的元素为___________ ,NH 中N的
中N的___________ 杂化轨道与H的1s轨道形成___________ 键。
(3)H2O分子的空间结构是___________ ,请用共价键知识解释H2O分子比NH3分子稳定的原因为___________ 。将纯液态SO3冷却到289.8 K时,能凝固得到一种螺旋状单链结构的固体,其结构如图所示,此固态SO3中S原子的杂化轨道类型与H2O中O的杂化轨道类型___________ (填“相同”或“不同”)。
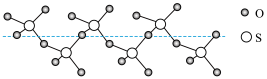
(4)下列说法正确的是___________。
(1)基态Fe2+中含
(2)(NH4)2Fe(SO4)26H2O中电负性最大的元素为
 中N的
中N的(3)H2O分子的空间结构是

(4)下列说法正确的是___________。
| A.分子的极性:BCl3<NCl3 |
| B.Mn的+2价比Fe的+2价稳定 |
| C.物质的沸点:HF<HCl |
| D.在CS2中的溶解度:CCl4<H2O |
您最近一年使用:0次
名校
解题方法
6 . 科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
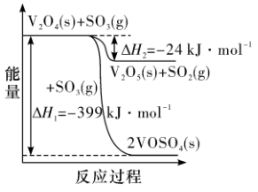
(1)钒催化剂参与反应的能量变化如图所示, 与
与 反应生成
反应生成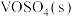 和
和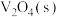 的热化学方程式为
的热化学方程式为___________ 。
(2) 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠 。
。 与
与 的空间结构相同,其中V原子的杂化方式为
的空间结构相同,其中V原子的杂化方式为________ ,写出一种空间结构与之相同的阳离子:________ (填离子符号)。
(3) 与双缩脲(
与双缩脲( )在碱性溶液中作用形成紫红色络合物。
)在碱性溶液中作用形成紫红色络合物。
①该配离子中不存在的作用力有___________ (填标号)。
a.离子键 b.共价键 c.配位键
②双缩脲中所含元素中为同周期的元素的第一电离能由大到小的顺序为___________ 。
(4)向 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子。
配离子。
①1mol 含有σ键的数目为
含有σ键的数目为___________ 。
②画出 的结构:
的结构:___________ (用“→”或“—”将配位键表示出来)。
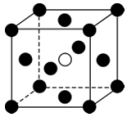
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为___________ 。若该晶体的密度是 ,则两个距离最近的Fe原子间的距离为
,则两个距离最近的Fe原子间的距离为___________ nm(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)钒催化剂参与反应的能量变化如图所示,
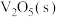 与
与 反应生成
反应生成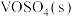 和
和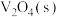 的热化学方程式为
的热化学方程式为
(2)
 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠 。
。 与
与 的空间结构相同,其中V原子的杂化方式为
的空间结构相同,其中V原子的杂化方式为(3)
 与双缩脲(
与双缩脲( )在碱性溶液中作用形成紫红色络合物。
)在碱性溶液中作用形成紫红色络合物。①该配离子中不存在的作用力有
a.离子键 b.共价键 c.配位键
②双缩脲中所含元素中为同周期的元素的第一电离能由大到小的顺序为
(4)向
 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子。
配离子。①1mol
 含有σ键的数目为
含有σ键的数目为②画出
 的结构:
的结构:(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为
 ,则两个距离最近的Fe原子间的距离为
,则两个距离最近的Fe原子间的距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
7 . 下列有关物质结构的说法正确的是
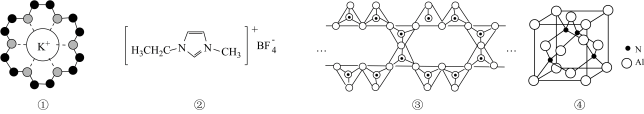
A.图①中18-冠-6通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
B.图②物质相较 摩尔质量更大,具有更高的熔沸点 摩尔质量更大,具有更高的熔沸点 |
C.图③中,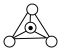 表示硅氧四面体,则该多硅酸根结构的通式为 表示硅氧四面体,则该多硅酸根结构的通式为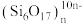 |
| D.图④表示氮化铝晶胞,则该晶体中存在共价键和配位键,且铝的配位数为6 |
您最近一年使用:0次
2023-12-16更新
|
967次组卷
|
4卷引用:湖南师范大学附属中学2023-2024学年高三上学期月考卷(四)化学试题
名校
解题方法
8 . 通过绿柱石(xBeO•yAl2O3•zSiO2)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
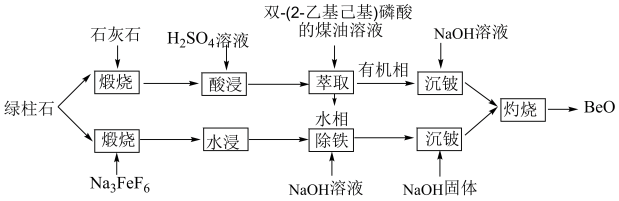
I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与_______ 元素(填元素符号)性质相似。
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有_______ 。
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为________ 。
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为_______ 。
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为________ (计算结果保留三位有效数字){已知:沉铍前,溶液中c(BeF )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是________ 。
(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。
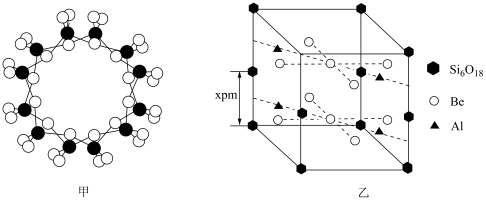

①z轴方向上,晶胞参数 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是_______ 。
②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为________ 。

I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为
 )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。


①z轴方向上,晶胞参数
 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为
您最近一年使用:0次
名校
解题方法
9 .  是生产多晶硅的副产物.利用
是生产多晶硅的副产物.利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
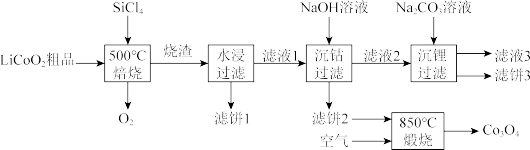
Ⅰ.回答下列问题:
(1) 价层电子排布式为
价层电子排布式为______ 。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是______ 。
(4)已知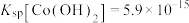 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有______ (填标号).
a.Si-Cl键极性更大 b.Si的原子半径更大 c.Si-Cl键键能更大 d.Si有更多的价层轨道
Ⅱ.设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
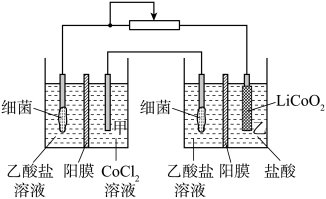
(6)装置工作时,甲室溶液pH逐渐______ ,乙室电极反应式为:______ 。
 是生产多晶硅的副产物.利用
是生产多晶硅的副产物.利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
Ⅰ.回答下列问题:
(1)
 价层电子排布式为
价层电子排布式为(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
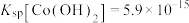 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大 c.Si-Cl键键能更大 d.Si有更多的价层轨道
Ⅱ.设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成
 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。
(6)装置工作时,甲室溶液pH逐渐
您最近一年使用:0次
名校
解题方法
10 . 硒化锌是一种重要的半导体材料,晶胞结构如图所示。下列说法正确的是
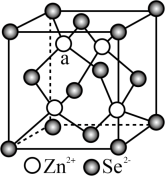

| A.a点离子所处空隙类型为四面体空隙 |
B. 的配位数为12 的配位数为12 |
C.基态Se原子的电子排布式为 |
D.若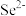 换为 换为 ,则晶胞棱长保持不变 ,则晶胞棱长保持不变 |
您最近一年使用:0次
2023-07-11更新
|
254次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题



