名校
解题方法
1 . 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为 ,硼砂的化学式为
,硼砂的化学式为 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:

已知: 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为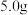 、
、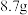 、
、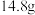 、
、 。
。
(1)B原子的电子排布式为________ 。
(2)硼砂溶于热水后,常用 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是________________________________________________ 。
(3)X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________________ 。
(4) 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是__________ 。
(5)已知硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是_______ 。

已知硼酸在水中电离产生 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是________ (填标号)。
A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.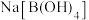 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中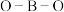 的键角相同
的键角相同
(6)制得的粗硼在一定条件下生成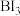 ,
,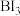 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的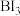 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为________ (提示: )
)
 ,硼砂的化学式为
,硼砂的化学式为 。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
。利用硼镁矿制取金属镁及粗硼的工艺流程如下。请回答下列有关问题:
已知:
 在20℃、40℃、60℃、100℃时溶解度依次为
在20℃、40℃、60℃、100℃时溶解度依次为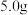 、
、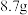 、
、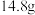 、
、 。
。(1)B原子的电子排布式为
(2)硼砂溶于热水后,常用
 调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是
调pH至2~3,紧接着再采用“热过滤”、冷却结晶获得硼酸晶体。“热过滤”的目的是(3)X为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(4)
 需要在
需要在 氛围中加热制
氛围中加热制 ,其目的是
,其目的是(5)已知硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
分子通过氢键(如图,用虚线表示)相连。硼酸在冷水中溶解度很小,但在热水中较大,原因是
已知硼酸在水中电离产生
 的过程为
的过程为 。下列有关硼酸及其相关化合物的说法正确的是
。下列有关硼酸及其相关化合物的说法正确的是A.硼酸的电离过程中有配位键形成 B.硼酸为三元酸
C.
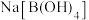 的水溶液呈碱性 D.硼酸和
的水溶液呈碱性 D.硼酸和 中
中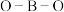 的键角相同
的键角相同(6)制得的粗硼在一定条件下生成
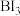 ,
,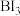 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将 粗硼制成的
粗硼制成的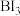 完全分解,生成的
完全分解,生成的 用
用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为 )
)
您最近一年使用:0次
名校
解题方法
2 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是___________ 。
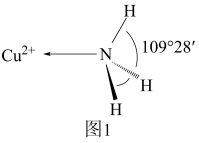
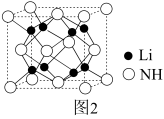
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-07-07更新
|
84次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期10月月考化学试题
解题方法
3 . 在人类提出水合氢离子概念一百多年来,我们首次在实空间里观测到水合氢离子的微观结构(两种构型的水合氢离子的结构模型如图),并发现了一种室温下保持在常压状态具有氢原子对称化构型的二维冰新物态。下列有关说法正确的是


A.(a)(b)中O原子均为 杂化 杂化 |
B.(a)(b)均可表示为 |
| C.(a)中存在的化学键有共价键、配位键、氢键 |
| D.水合氢离子组装形成的二维冰相和干冰均为共价晶体 |
您最近一年使用:0次
2023-05-18更新
|
562次组卷
|
3卷引用:湖南省部分学校2023届高三下学期5月联考化学试题
解题方法
4 . 前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)E的元素名称为________ 。
(2)元素A、B、C中,电负性最大的是________ (填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________ 。
(3)BA3分子中键角__________ (填“>”“<”或“=”)109°28′。
(4)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为________ ,BC 的空间结构为
的空间结构为________ 。
(1)E的元素名称为
(2)元素A、B、C中,电负性最大的是
(3)BA3分子中键角
(4)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
5 . 2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)要证明月壤中含有这些元素,可采用的方法是_______ 。
(2)月球表面的月海玄武岩中富含钛和铁,将月海玄武岩用硝酸溶解,所得溶液用 检验,溶液呈红色。
检验,溶液呈红色。 中K、C、N的电负性从大到小的顺序是
中K、C、N的电负性从大到小的顺序是_______ ,C原子的杂化轨道类型是_______ , 的空间构型是
的空间构型是_______ 形,1
 中含有的
中含有的 键数目是
键数目是_______ 。
(3)嫦娥五号采样机中的钻杆是由中国科学院科学家研制的碳化硅增强铝基复合材料制成,具有轻质、高刚度、高强度和耐磨损等特点。
①铝基复合材料中有一种重要的物质氮化铝( ,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于
,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于_______ (填晶体类型)。
②氮化铝的晶体结构如图所示,其中铝原子的配位数是_______ 。

(1)要证明月壤中含有这些元素,可采用的方法是
(2)月球表面的月海玄武岩中富含钛和铁,将月海玄武岩用硝酸溶解,所得溶液用
 检验,溶液呈红色。
检验,溶液呈红色。 中K、C、N的电负性从大到小的顺序是
中K、C、N的电负性从大到小的顺序是 的空间构型是
的空间构型是
 中含有的
中含有的 键数目是
键数目是(3)嫦娥五号采样机中的钻杆是由中国科学院科学家研制的碳化硅增强铝基复合材料制成,具有轻质、高刚度、高强度和耐磨损等特点。
①铝基复合材料中有一种重要的物质氮化铝(
 ,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于
,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于②氮化铝的晶体结构如图所示,其中铝原子的配位数是

您最近一年使用:0次
2023-03-25更新
|
137次组卷
|
2卷引用:湖南省衡阳市衡阳县第四中学2022-2023学年高二下学期期中考试化学试题
名校
6 . 物质的组成与结构决定了物质的性质与变化。下列说法正确的是
| A.MgO的熔点高于NaCl的熔点 |
| B.金刚石与碳化硅晶体结构相似,金刚石的硬度小于碳化硅 |
| C.CH3CH2CH2COOH的酸性比CH3COOH的酸性强 |
| D.HF晶体沸点高于HCl,是因为HCl共价键键能小于HF |
您最近一年使用:0次
2023-03-18更新
|
682次组卷
|
5卷引用:湖南省长沙市周南中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
7 . 短周期元素X、Y、Z、W中,X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M电子层的p能级中有3个未成对电子。
(1)Z原子的电子排布式为_______ ,若X为非金属元素,则按原子轨道的重叠方式,X与Z形成的化合物中的共价键属于_______ 键(填“σ”或“x”)。
(2)当 时,Y在元素周期表的位置为
时,Y在元素周期表的位置为____ ,YZ2属于____ 分子(填“极性”或“非极性”)。
(3)当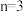 时,YZ2晶体属于
时,YZ2晶体属于_______ 晶体;在Y的含氧酸盐中,Y和Z结合成 四面体,
四面体, 的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为_______ 。

(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(1)Z原子的电子排布式为
(2)当
 时,Y在元素周期表的位置为
时,Y在元素周期表的位置为(3)当
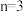 时,YZ2晶体属于
时,YZ2晶体属于 四面体,
四面体, 的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
的四面体结构单元通过共用顶角的方式形成一种无限长单链结构的酸根离子(如图),则其中Y与Z的原子数之比为
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
名校
解题方法
8 . 一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为apm、apm、bpm,1号原子的坐标为( ,
, ,
, ),下列说法错误的是
),下列说法错误的是

 ,
, ,
, ),下列说法错误的是
),下列说法错误的是
A.2号原子的坐标为( , , , ,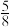 ) ) |
| B.距离硫原子最近的硫原子数目为4 |
| C.硫原子的配位数为4 |
D.该晶体的密度为 g/cm3 g/cm3 |
您最近一年使用:0次
2023-02-02更新
|
1415次组卷
|
5卷引用:湖南师范大学附属中学2023届高三下学期月考(七)化学试题
湖南师范大学附属中学2023届高三下学期月考(七)化学试题广东省江门市部分名校2023届高三高考仿真模拟测试化学试题山西省忻州市2023届高三一模考试理综化学试题(已下线)专题卷20 《物质结构与性质》选择题分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河南省信阳高级中学2023-2024学年高三上学期2月月考理综试题-高中化学
解题方法
9 . C、Si均为第ⅣA族元素,回答下列问题。
(1)若将基态硅原子最高能级的电子排布图表示为 ,则它违背了
,则它违背了___________ 这一电子排布规律。
(2)以SiO2为基本原料制备粗硅的原理为 ,则C、O、Si第一电离能由大到小的顺序为
,则C、O、Si第一电离能由大到小的顺序为___________ 。
(3)CO2和SiO2两种物质中,C、Si原子的杂化类型分别为___________ ;CO2的熔点远低于SiO2的原因是___________ 。
(4) 的键角为
的键角为___________ ;写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(5)硅的含氧化合物都以硅氧四面体( )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为___________ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为___________ 。

(1)若将基态硅原子最高能级的电子排布图表示为
 ,则它违背了
,则它违背了(2)以SiO2为基本原料制备粗硅的原理为
 ,则C、O、Si第一电离能由大到小的顺序为
,则C、O、Si第一电离能由大到小的顺序为(3)CO2和SiO2两种物质中,C、Si原子的杂化类型分别为
(4)
 的键角为
的键角为 互为等电子体的分子
互为等电子体的分子(5)硅的含氧化合物都以硅氧四面体(
 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
您最近一年使用:0次
2023-01-10更新
|
252次组卷
|
2卷引用:湖南省怀化市2022-2023学年高三下学期期末考试化学试题
名校
解题方法
10 . 铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态铜原子的价层电子排布式为_______ ,其核外电子的空间运动状态有_______ 种
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是_______ (填标号)。
A.原子光谱 B.质谱 C.红外光谱
(3)石青的化学式为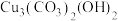 ,其中
,其中 的空间构型为
的空间构型为_______
(4)已知 分子中
分子中 的键角为
的键角为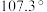 ,则配合物
,则配合物 中
中 的键角
的键角_______ 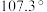 (填“大于”“小于”“等于”)。
(填“大于”“小于”“等于”)。
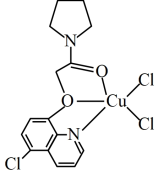
(5) 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______ , 该有机配体与
该有机配体与 (II)形成的配位键为
(II)形成的配位键为_______  。
。
(6) 晶胞中
晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心。
所构成的四面体中心。

若晶胞参数 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___ (用含a和d的式子表示)。
(1)基态铜原子的价层电子排布式为
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是
A.原子光谱 B.质谱 C.红外光谱
(3)石青的化学式为
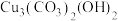 ,其中
,其中 的空间构型为
的空间构型为(4)已知
 分子中
分子中 的键角为
的键角为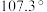 ,则配合物
,则配合物 中
中 的键角
的键角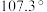 (填“大于”“小于”“等于”)。
(填“大于”“小于”“等于”)。(5)
 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为 该有机配体与
该有机配体与 (II)形成的配位键为
(II)形成的配位键为 。
。
(6)
 晶胞中
晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心。
所构成的四面体中心。
若晶胞参数
 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2022-11-19更新
|
616次组卷
|
3卷引用:湖南省株洲市第四中学2022-2023学年高三上学期第三次月考化学试题



