河南省名师联盟2020届高三下学期5月联考理综化学试题
河南
高三
模拟预测
2020-06-24
688次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
河南省名师联盟2020届高三下学期5月联考理综化学试题
河南
高三
模拟预测
2020-06-24
688次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 化学与生产、生活密切相关,下列有关说法正确的是( )
| A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅 |
| B.硅胶、CaO、P2O5都可用作食品干燥剂 |
| C.我国积极倡导“低碳经济”,将煤液化就是一种“低碳”方式 |
| D.可利用新制Cu(OH)2悬浊液检验患者尿液中是否含有葡萄糖 |
【知识点】 硅的物理性质与用途解读 葡萄糖与新制氢氧化铜溶液的反应 煤的液化解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列实验“操作和现象”与“结论”对应且正确的是( )
| 操作和现象 | 结论 | |
| A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
| B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I ⇌I2+I- ⇌I2+I- |
| C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
3. 化合物A是一种危险化学制品,具有腐蚀性、可自燃性。主要用于医药工业,在有机合成中用作催化剂等。其结构如图所示,其中W、X、Y、Z是处于三个不同短周期且原子序数依次递增的常见元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数的3倍。下列叙述正确的是( )
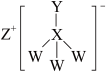
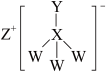
| A.原子半径:Y>X>Z>W |
| B.简单气态氢化物的稳定性:X>Y |
| C.X与W形成的常见化合物有两种 |
| D.W和Z形成的化合物为离子化合物 |
您最近一年使用:0次
2020-06-23更新
|
254次组卷
|
2卷引用:河南省名师联盟2020届高三下学期5月联考理综化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 某酯的相对分子质量不大于160,可表示为CnH2nO2(n为整数)。在酸性条件下能水解生成两种相对分子质量相等的酸和醇,且该醇最终可被氧化为羧酸,不考虑立体异构,则满足该条件的酯有( )
| A.12种 | B.14种 | C.23种 | D.28种 |
您最近一年使用:0次
2020-06-23更新
|
200次组卷
|
3卷引用:河南省名师联盟2020届高三下学期5月联考理综化学试题
5. 铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
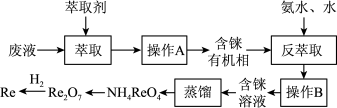

| A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4- |
| B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用 |
| C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re |
| D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( )
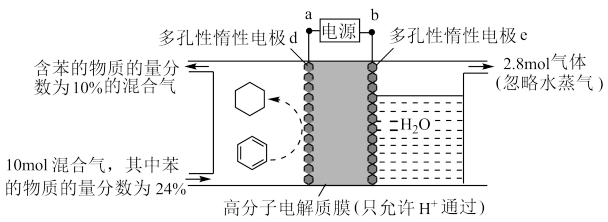

| A.电子移动方向为:a→d;e→b |
| B.d电极反应式为C6H6+6H++6e-=C6H12 |
| C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成 |
| D.由图中数据可知,此装置的电流效率约为32.1% |
您最近一年使用:0次
单选题
|
适中(0.65)
7. 常温时,浓度均为1mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。下列说法正确的是( )
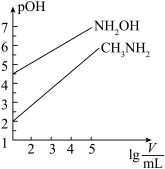

A.当两溶液均稀释至lg =5时,溶液中水的电离程度:NH2OH<CH3NH2 =5时,溶液中水的电离程度:NH2OH<CH3NH2 |
| B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂 |
| C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-) |
| D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH+) |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:
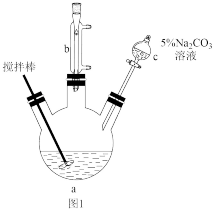

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___ ,本实验中最容易产生的副产物的结构简式为___ 。
(2)仪器b的作用为___ 。
(3)混合液用5%Na2CO3溶液洗涤的目的是___ 。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___ 。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___ ,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___ 。


回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为
(2)仪器b的作用为
(3)混合液用5%Na2CO3溶液洗涤的目的是
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为
您最近一年使用:0次
2020-06-23更新
|
325次组卷
|
3卷引用:河南省名师联盟2020届高三下学期5月联考理综化学试题
解答题-工业流程题
|
适中(0.65)
解题方法
9. 高锰酸钾是锰的重要化合物和常用的氧化剂。如图是在实验室中制备KMnO4晶体的流程:
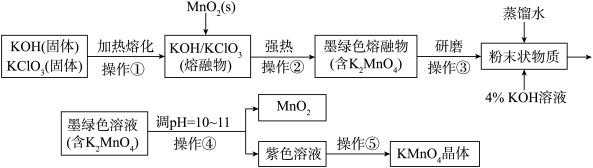
回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择___ (填序号)。
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有_______ 。
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为___ 。若溶液碱性过强,则 又会转化为
又会转化为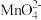 ,同时产生无色气体,该转化过程中发生反应的离子方程式为
,同时产生无色气体,该转化过程中发生反应的离子方程式为___ 。
(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。

①电解过程中右侧石墨电极的电极反应式为________ 。
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是________ 。
③为避免该现象,请提出改进装置的措施:________ 。

回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为
 又会转化为
又会转化为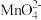 ,同时产生无色气体,该转化过程中发生反应的离子方程式为
,同时产生无色气体,该转化过程中发生反应的离子方程式为(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。

①电解过程中右侧石墨电极的电极反应式为
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是
③为避免该现象,请提出改进装置的措施:
您最近一年使用:0次
2020-06-23更新
|
249次组卷
|
2卷引用:河南省名师联盟2020届高三下学期5月联考理综化学试题
解答题-原理综合题
|
较难(0.4)
解题方法
10. 甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
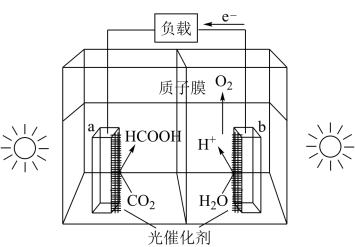
该装置能量转化方式为___ 。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2⇌RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
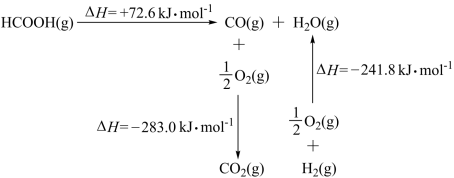
反应CO2(g)+H2(g) ⇌ HCOOH(g)的焓变△H=___ kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) ⇌ HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___ (以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___ T1℃时平衡压强(填“>”“<”或“=”),理由是___ 。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
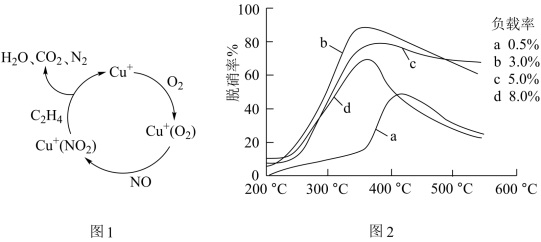
①写出该脱硝原理总反应的化学方程式:___ 。
②为达到最佳脱硝效果,应采取的条件是___ 。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- ⇌HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___ (T℃时甲酸的电离常数为2×10-4)。
(1)利用光催化制甲酸原理如图所示。

该装置能量转化方式为
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2⇌RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2快反应
下列表述正确的是
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:

反应CO2(g)+H2(g) ⇌ HCOOH(g)的焓变△H=
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) ⇌ HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- ⇌HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
您最近一年使用:0次
解答题-结构与性质
|
困难(0.15)
名校
解题方法
11. 碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
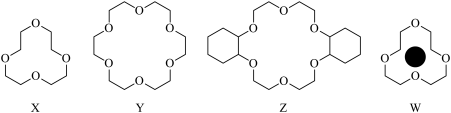
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___ 种运动状态不同的电子,其外围电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
③冠醚分子中氧的杂化轨道的空间构型是___ ,C—O—C的键角___ (填“>”“<”或“=”)109°28′。
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___ 个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加 德罗常数的值为NA,计算石墨晶体的层间距d为___ cm。
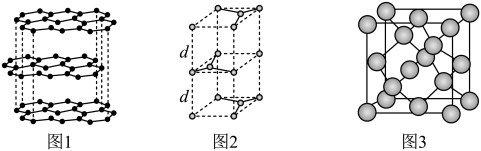
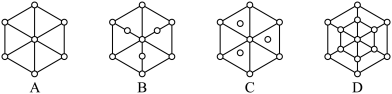
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
③冠醚分子中氧的杂化轨道的空间构型是
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为

(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图

您最近一年使用:0次
2020-06-23更新
|
1030次组卷
|
3卷引用:河南省名师联盟2020届高三下学期5月联考理综化学试题
解答题-有机推断题
|
较难(0.4)
解题方法
12. 某抗肿瘤药物的有效成分为E,其一种合成路线如图:
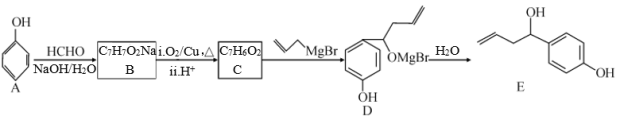
回答下列问题:
(1)质谱图显示有机物A的最大质荷比为___ 。
(2)E分子中官能团的名称是___ ;A→B的反应类型包括中和反应和___ 。
(3)常温下,E不能与下列试剂反应的是___ (填字母)。
a.H2 b.FeCl3溶液 c.溴水 d.NaHCO3
(4)在冰水浴条件下,E与乙酸酐[(CH3CO)2O]反应生成一种香料M,1个M分子中含2个酯基。由E合成M的化学方程式为___ 。
(5)T是C的同系物,T的相对分子质量比C多28,则T的同分异构体中,满足下列条件的同分异构体有___ 种(不考虑立体异构)。
①属于芳香族化合物②既能发生水解反应又能发生银镜反应
其中核磁共振氢谱有4组峰且峰面积之比为1:1:2:6的T的所有可能结构为___ 。
(6)已知:RBr RMgBr。设计由环己烯和乙醛制备化合物
RMgBr。设计由环己烯和乙醛制备化合物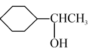 的合成路线
的合成路线___ (无机试剂和某些有机试剂任选)。

回答下列问题:
(1)质谱图显示有机物A的最大质荷比为
(2)E分子中官能团的名称是
(3)常温下,E不能与下列试剂反应的是
a.H2 b.FeCl3溶液 c.溴水 d.NaHCO3
(4)在冰水浴条件下,E与乙酸酐[(CH3CO)2O]反应生成一种香料M,1个M分子中含2个酯基。由E合成M的化学方程式为
(5)T是C的同系物,T的相对分子质量比C多28,则T的同分异构体中,满足下列条件的同分异构体有
①属于芳香族化合物②既能发生水解反应又能发生银镜反应
其中核磁共振氢谱有4组峰且峰面积之比为1:1:2:6的T的所有可能结构为
(6)已知:RBr
 RMgBr。设计由环己烯和乙醛制备化合物
RMgBr。设计由环己烯和乙醛制备化合物 的合成路线
的合成路线
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 硅的物理性质与用途 葡萄糖与新制氢氧化铜溶液的反应 煤的液化 | |
| 2 | 0.65 | 浓硫酸的强氧化性 化学平衡状态本质及特征 测定溶液pH的方法 沉淀的溶解与生成 | |
| 3 | 0.65 | 烃、烷烃的概念 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据原子结构进行元素种类推断 | |
| 4 | 0.65 | 根据要求书写同分异构体 醇的催化氧化 酯的水解反应机理 有机物的推断 | |
| 5 | 0.65 | 氧化还原反应有关计算 物质分离、提纯的常见物理方法 物质分离、提纯综合应用 常见无机物的制备 | |
| 6 | 0.65 | 电解原理的理解及判断 电解池电解基本判断 电解池电极反应式及化学方程式的书写与判断 电解池有关计算 | |
| 7 | 0.65 | 水溶液中水的电离程度及的计算 溶液稀释时pH的变化图像 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 乙醇的消去反应 酯化反应的机理 探究物质组成或测量物质的含量 物质制备的探究 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 二氧化硅的化学性质 电解原理的应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 盖斯定律及其有关计算 常见能量转化形式 化学平衡的移动及其影响因素 电离平衡常数及影响因素 | 原理综合题 |
| 11 | 0.15 | 物质结构与性质综合考查 利用杂化轨道理论判断分子的空间构型 简单配合物的成键 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 单烯烃的加成反应 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |



