名校
解题方法
1 . N、P同属于第VA族元素。试回答下列问题。
(1)基态N原子核外电子的空间运动状态有___________ 种。
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角___________ (填“>”“<”或“=”)NH3分子中的H—N—H键角。1mol[Co(NH3)5Cl]Cl2中含有的σ键数目为___________ NA。
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3___________ (填“高”或“低”),原因是___________ 。
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其主要原因是___________ 。
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:___________ 。
(1)基态N原子核外电子的空间运动状态有
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
您最近一年使用:0次
名校
解题方法
2 . 金属锡及其化合物在生产和科研中应用广泛。回答下列问题:
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。_______ ,在周期表中的位置为_______ ,C、Si、Cl电负性由大到小的顺序为_______ 。
②该化合物中共有_______ 种杂化方式;提供电子对形成配位键的原子是_______ 。
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。_______ ,晶胞中Sn的配位数与Cu的配位数之比为_______ 。
②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为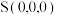 、
、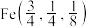 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为_______ ;晶胞中Sn原子和Cu原子间的最短距离为_______ pm。
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。
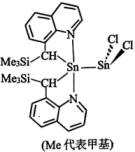
②该化合物中共有
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。

②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为
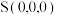 、
、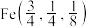 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为
您最近一年使用:0次
解题方法
3 . 学科融合是现代发展的大趋势,化学家利用“热电效应”理论将氮族元素、VIII族元素和稀土元素合成了具有热电效应的晶体。
(1)现代化学中,常用____ (填“原子光谱”“分子光谱”)上的特征谱线来鉴定元素,称为光谱分析。
(2)第VIII族元素中的Fe、Co、Ni都是常见金属,Fe3+比Fe2+稳定的原因是____ 。Co、Ni与NH3易形成配合物,如[Co(NH3)5H2O]Cl3和[Ni(N3)6]Cl2,配位数分别为____ 、____ ;H2O比NH3的沸点高,原因为____ 。
(3)P与Br可形成多种化合物,如图表示磷、硅、碳的四级电离变化趋势,其中表示磷元素的曲线是_____ (填标号)。PBr5为阴阳离子比为1:1的导电熔体,阴阳离子均带一个单位电荷,阴离子为单核微粒,其中P原子的杂化轨道类型为____ 。

(4)合成热电效应的一种晶体的晶胞如图所示,其中Fe原子处于Sb原子形成的八面体中心。晶胞参数为anm,NA表示阿伏加德罗常数的值,则晶体密度为____ g/cm3(用含a、NA的代数式表示)。

(1)现代化学中,常用
(2)第VIII族元素中的Fe、Co、Ni都是常见金属,Fe3+比Fe2+稳定的原因是
(3)P与Br可形成多种化合物,如图表示磷、硅、碳的四级电离变化趋势,其中表示磷元素的曲线是

(4)合成热电效应的一种晶体的晶胞如图所示,其中Fe原子处于Sb原子形成的八面体中心。晶胞参数为anm,NA表示阿伏加德罗常数的值,则晶体密度为

您最近一年使用:0次
2022-05-01更新
|
698次组卷
|
2卷引用:山东省2022届高三二轮复习联考(二)化学试题
解题方法
4 . 硼的总浓度≥0.4mol·L-1的硼酸及其盐的水溶液中不仅存在四硼酸根离子
B4O5(OH) ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。
(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)_______ 。
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式_______ 。
注:以B4O5(OH) 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。

B4O5(OH)
 ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式
注:以B4O5(OH)
 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
您最近一年使用:0次
解题方法
5 . (1)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,写出该分子中铁的价电子排布式_______ ,该分子中氧的化合价有_______ ,画出该分子的结构示意图_______ 。
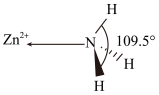
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为_______ 。下图是[Zn(NH3)6]2+离子的部分结构以及∠H-N-H的测量值,解释配合物中键角变化的原因_______ 。
(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是_______ 。这类聚合物强度远超尼龙纤维,与钢铁近乎相同,科学研究表明其聚合物链与链之间存在苯环苯环的相互作用,除此之外还可能因为_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
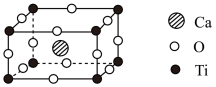
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是________ cm(已知晶胞参数为anm)。
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为

(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2021-05-31更新
|
1689次组卷
|
2卷引用:四川省凉山州2021届高三第二次诊断考试理科综合化学试题



